Piezo1激活劑Yoda1的作用機制及在細胞機械信號轉導等研究中的應用
機械敏感離子通道Piezo1是近年來生命科學領域的重要發現之一。在多種生理過程中,Piezo1都扮演著不可或缺的角色,從紅細胞的體積調控、血管發育到觸覺感知、血壓調節等。Yoda1(AbMole,M9372)作為 Piezo1的激活劑,它的出現,為 Piezo1 的相關研究提供了有力工具。AbMole為全球科研客戶提供高純度、高生物活性的抑制劑、細胞因子、人源單抗、天然產物、熒光染料、多肽、靶點蛋白、化合物庫、抗生素等科研試劑,全球大量文獻專利引用。
一、Yoda1 的作用機制
Piezo1由多個跨膜結構域組成,其獨特的三葉螺旋槳狀結構賦予了它感知細胞膜機械力變化的能力。Yoda1(AbMole,M9372)作為一種小分子激動劑,能夠穩定Piezo1通道的開放構象,從而降低其對機械刺激的激活閾值,或在沒有機械刺激的情況下激活Piezo1通道。Yoda1對Piezo1具有高度特異性,Yoda1的作用位點位于Piezo1的1961-2063氨基酸區域,這一區域被稱為激動劑轉導基序(Agonist Transduction Motif, ATM),該基序位于每個亞基的葉片和孔域的交界處,值得注意的是Yoda1結合Piezo1三個亞基中的任意一個基序,均可激活Piezo1[1]。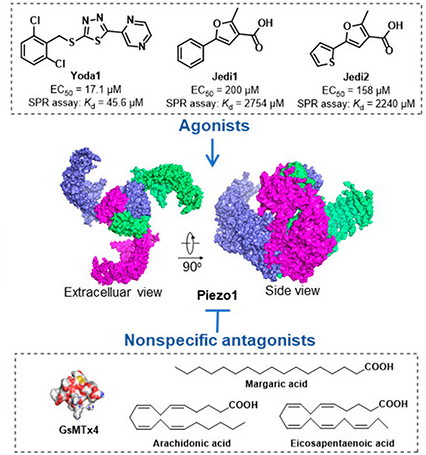

圖 1. Piezo1的結構和相關抑制劑、激動劑[2]
二、Yoda1的研究應用
1. Yoda1被用于研究細胞的機械信號轉導
Piezo1是細胞機械信號轉導研究領域中的熱門靶點,研究人員可利用Yoda1(AbMole,M9372)在體內體外的實驗中激活Piezo1,模擬機械力作用(如血流剪切力、細胞基質壓陷)。Piezo1的激活可以影響多條通路,例如Ca²+/CREB信號通路、RhoA/ROCK-YAP/TAZ信號軸、ERK信號通路等[3]。因此Yoda1在上述通路中也有著重要的應用。
在紅細胞研究中,Yoda1激活Piezo1后,紅細胞的體積和形態得到有效調節。研究人員通過動態光散射和電子顯微鏡等技術,直觀地觀察到紅細胞在Yoda1作用下的形態變化,這不僅有助于理解紅細胞在血液循環中適應不同機械環境的機制,還為研究貧血、紅細胞增多癥等狀態下紅細胞異常的根源提供了新視角[4]。此外,在成纖維細胞研究中,Yoda1激活Piezo1能夠影響細胞的遷移行為。通過劃痕實驗和實時細胞分析系統發現,激活后的成纖維細胞遷移速度加快,細胞骨架的動態重組也更為活躍,這為深入研究傷口愈合過程中細胞的機械響應機制奠定了基礎[5]。2014年,AbMole的兩款抑制劑分別被西班牙國家心血管研究中心和美國哥倫比亞大學用于動物體內實驗,相關科研成果發表于頂刊 Nature 和 Nature Medicine。
2. Yoda1用于動物疾病模型構建與抑制研究
Yoda1(AbMole,M9372)也是一種被廣泛使用的動物實驗造模劑,例如Yoda1可以用于構建小鼠動脈粥樣硬化模型[6],其機理是Yoda1可促進血管平滑肌細胞的增殖與遷移,并導致炎癥因子如白細胞介素-6(IL-6)、腫瘤壞死因子-α(TNF-α)的分泌增加,從而促進炎癥反應和細胞的異常增殖遷移,最終加速了動脈粥樣硬化斑塊的形成和進展。
也有研究表明Piezo1在間充質干細胞(MSCs)、成骨細胞(Osteoblasts)和骨細胞(Osteocytes)中高表達,它介導胞外機械信號向胞內電化學信號的轉導過程,從而在調控骨穩態、促進骨重塑過程中起著關鍵性的作用。因此,作為Piezo1激動劑的Yoda1(AbMole,M9372)有望成為抑制骨質疏松癥、骨髓損傷的新策略[7]。在脊髓損傷模型中,應用 Yoda1 激活Piezo1后,研究人員發現其對神經元的存活和軸突再生具有一定的調節作用[8]。通過免疫熒光染色和行為學檢測發現,Yoda1處理組的神經元存活率明顯提高,軸突再生長度增加,且動物的運動功能也得到一定程度的改善。此外,Piezo1還可用于杜氏肌營養不良癥[9]、阿爾茨海默病模型等多種疾病模型的研究[10]。
三、范例詳解
1. Skelet Muscle. 2025 May 14;15(1):13.
鄭州大學第一附屬醫院的科研人員探究了杜氏肌營養不良(DMD)動物模型中PIEZO1通道的作用,特別是對肌肉再生和肌纖維損傷的影響。研究發現,PIEZO1在DMD模型的骨骼肌中表達上調,主要在衛星細胞中表達。GsMTx4通過阻斷PIEZO1通道,能夠促進肌生成分化,減輕肌纖維損傷。由AbMole提供的Yoda1(AbMole,M9372)作為PIEZO1通道的激動劑,在實驗中用于對比GsMTx4的效果,以驗證PIEZO1通道在肌生成分化和肌纖維損傷中的作用[9]。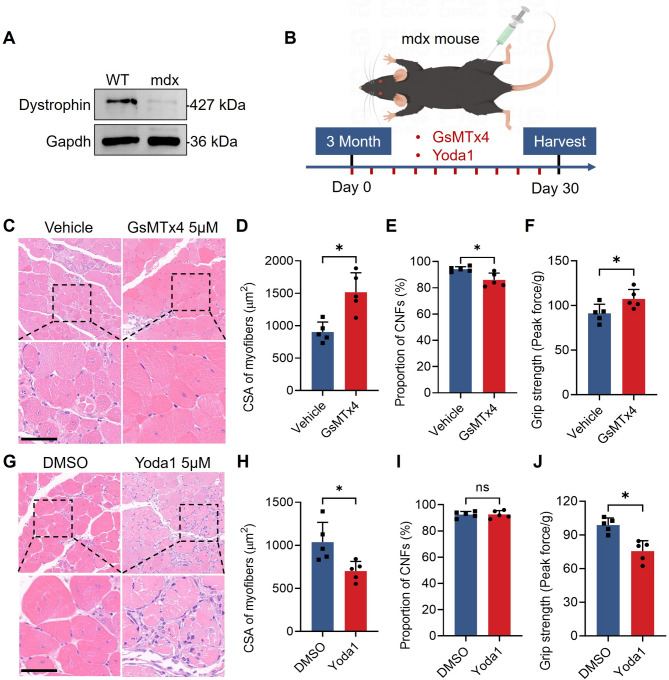
 圖 2. GsMTx4-blocked PIEZO1 channel ameliorates muscular dystrophy in mdx mice[9].
圖 2. GsMTx4-blocked PIEZO1 channel ameliorates muscular dystrophy in mdx mice[9].
2. Glia. 2023 May;71(5):1233-1246.
清華大學藥學院、北京眼科研究所的實驗人員探究了Piezo1在視神經(Optic Nerve Head, ONH)星形膠質細胞的細胞周期進程中的作用。研究發現,Piezo1在ONH星形膠質細胞中表達豐富,且對于細胞周期進程至關重要。通過操縱Piezo1的敲低或過表達,研究人員發現Piezo1對于ONH星形膠質細胞的增殖是必要的,但單獨的Piezo1并不足以促進細胞增殖。Piezo1的缺失會導致細胞周期在G0/G1期停滯,可能涉及YAP(Yes-Associated Protein)的核定位的減少和下調受YAP調節的細胞周期相關因子,包括Cyclin D1和c-Myc。此外,通過RNA測序后的GO富集分析表明,Piezo1的缺失影響涉及細胞分裂的生物活動。AbMole的Yoda1(AbMole,M9372)被作為Piezo1通道的特異性激動劑,在實驗中用于激活Piezo1通道,以研究其對ONH星形膠質細胞內鈣信號的影響。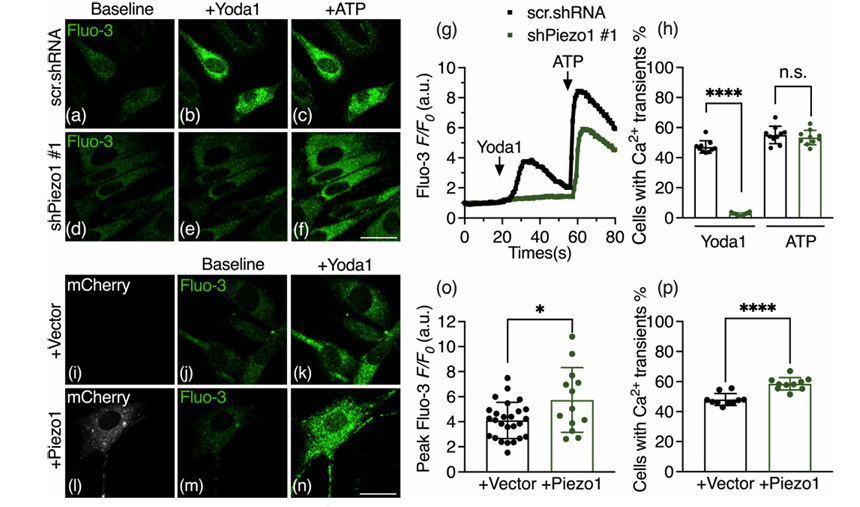
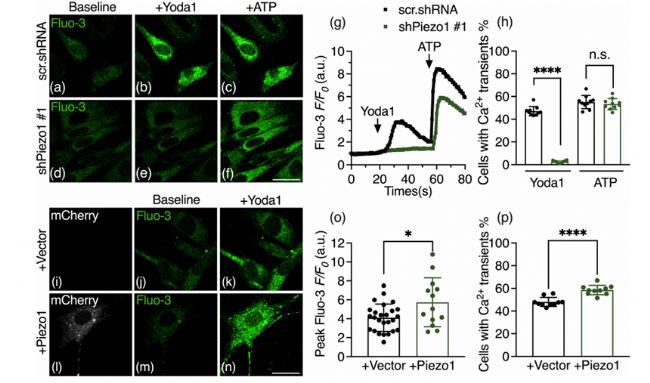 圖 3. Piezo1activation by Yoda1 regulates intracellular calcium signaling in primary ONH astrocytes[11].
圖 3. Piezo1activation by Yoda1 regulates intracellular calcium signaling in primary ONH astrocytes[11].
AbMole是ChemBridge中國區官方指定合作伙伴。


參考文獻
[1] Jerome J. Lacroix, Wesley M. Botello-Smith, Yun Luo, Probing the gating mechanism of the mechanosensitive channel Piezo1 with the small molecule Yoda1, Nature Communications 9(1) (2018) 2029.
[2] Hairong Tang, Ruoqing Zeng, Ende He, et al., Piezo-Type Mechanosensitive Ion Channel Component 1 (Piezo1): A Promising Therapeutic Target and Its Modulators, Journal of Medicinal Chemistry 65(9) (2022) 6441-6453.
[3] B. Coste, J. Mathur, M. Schmidt, et al., Piezo1 and Piezo2 are essential components of distinct mechanically activated cation channels, Science (New York, N.Y.) 330(6000) (2010) 55-60.
[4] S. Wang, R. Chennupati, H. Kaur, et al., Endothelial cation channel PIEZO1 controls blood pressure by mediating flow-induced ATP release, The Journal of clinical investigation 126(12) (2016) 4527-4536.
[5] V. I. Chubinskiy-Nadezhdin, V. Y. Vasileva, I. O. Vassilieva, et al., Agonist-induced Piezo1 activation suppresses migration of transformed fibroblasts, Biochemical and biophysical research communications 514(1) (2019) 173-179.
[6] J. Mao, R. Yang, P. Yuan, et al., Different stimuli induce endothelial dysfunction and promote atherosclerosis through the Piezo1/YAP signaling axis, Archives of biochemistry and biophysics 747 (2023) 109755.
[7] J. Yang, K. Yuan, T. Zhang, et al., Accelerated Bone Reconstruction by the Yoda1 Bilayer Membrane via Promotion of Osteointegration and Angiogenesis, Advanced healthcare materials 12(18) (2023) e2203105.
[8] A. Dolgorukova, J. E. Isaeva, E. Verbitskaya, et al., Differential effects of the Piezo1 agonist Yoda1 in the trigeminovascular system: An electrophysiological and intravital microscopy study in rats, Experimental neurology 339 (2021) 113634.
[9] W. Wang, M. Huang, X. Huang, et al., GsMTx4-blocked PIEZO1 channel promotes myogenic differentiation and alleviates myofiber damage in Duchenne muscular dystrophy, Skeletal muscle 15(1) (2025) 13.
[10] M. Velasco-Estevez, M. Mampay, H. Boutin, et al., Infection Augments Expression of Mechanosensing Piezo1 Channels in Amyloid Plaque-Reactive Astrocytes, Frontiers in aging neuroscience 10 (2018) 332.
[11] Y. Wan, H. Wang, X. Fan, et al., Mechanosensitive channel Piezo1 is an essential regulator in cell cycle progression of optic nerve head astrocytes, Glia 71(5) (2023) 1233-1246.
一、Yoda1 的作用機制
Piezo1由多個跨膜結構域組成,其獨特的三葉螺旋槳狀結構賦予了它感知細胞膜機械力變化的能力。Yoda1(AbMole,M9372)作為一種小分子激動劑,能夠穩定Piezo1通道的開放構象,從而降低其對機械刺激的激活閾值,或在沒有機械刺激的情況下激活Piezo1通道。Yoda1對Piezo1具有高度特異性,Yoda1的作用位點位于Piezo1的1961-2063氨基酸區域,這一區域被稱為激動劑轉導基序(Agonist Transduction Motif, ATM),該基序位于每個亞基的葉片和孔域的交界處,值得注意的是Yoda1結合Piezo1三個亞基中的任意一個基序,均可激活Piezo1[1]。


圖 1. Piezo1的結構和相關抑制劑、激動劑[2]
二、Yoda1的研究應用
1. Yoda1被用于研究細胞的機械信號轉導
Piezo1是細胞機械信號轉導研究領域中的熱門靶點,研究人員可利用Yoda1(AbMole,M9372)在體內體外的實驗中激活Piezo1,模擬機械力作用(如血流剪切力、細胞基質壓陷)。Piezo1的激活可以影響多條通路,例如Ca²+/CREB信號通路、RhoA/ROCK-YAP/TAZ信號軸、ERK信號通路等[3]。因此Yoda1在上述通路中也有著重要的應用。
在紅細胞研究中,Yoda1激活Piezo1后,紅細胞的體積和形態得到有效調節。研究人員通過動態光散射和電子顯微鏡等技術,直觀地觀察到紅細胞在Yoda1作用下的形態變化,這不僅有助于理解紅細胞在血液循環中適應不同機械環境的機制,還為研究貧血、紅細胞增多癥等狀態下紅細胞異常的根源提供了新視角[4]。此外,在成纖維細胞研究中,Yoda1激活Piezo1能夠影響細胞的遷移行為。通過劃痕實驗和實時細胞分析系統發現,激活后的成纖維細胞遷移速度加快,細胞骨架的動態重組也更為活躍,這為深入研究傷口愈合過程中細胞的機械響應機制奠定了基礎[5]。2014年,AbMole的兩款抑制劑分別被西班牙國家心血管研究中心和美國哥倫比亞大學用于動物體內實驗,相關科研成果發表于頂刊 Nature 和 Nature Medicine。
2. Yoda1用于動物疾病模型構建與抑制研究
Yoda1(AbMole,M9372)也是一種被廣泛使用的動物實驗造模劑,例如Yoda1可以用于構建小鼠動脈粥樣硬化模型[6],其機理是Yoda1可促進血管平滑肌細胞的增殖與遷移,并導致炎癥因子如白細胞介素-6(IL-6)、腫瘤壞死因子-α(TNF-α)的分泌增加,從而促進炎癥反應和細胞的異常增殖遷移,最終加速了動脈粥樣硬化斑塊的形成和進展。
也有研究表明Piezo1在間充質干細胞(MSCs)、成骨細胞(Osteoblasts)和骨細胞(Osteocytes)中高表達,它介導胞外機械信號向胞內電化學信號的轉導過程,從而在調控骨穩態、促進骨重塑過程中起著關鍵性的作用。因此,作為Piezo1激動劑的Yoda1(AbMole,M9372)有望成為抑制骨質疏松癥、骨髓損傷的新策略[7]。在脊髓損傷模型中,應用 Yoda1 激活Piezo1后,研究人員發現其對神經元的存活和軸突再生具有一定的調節作用[8]。通過免疫熒光染色和行為學檢測發現,Yoda1處理組的神經元存活率明顯提高,軸突再生長度增加,且動物的運動功能也得到一定程度的改善。此外,Piezo1還可用于杜氏肌營養不良癥[9]、阿爾茨海默病模型等多種疾病模型的研究[10]。
三、范例詳解
1. Skelet Muscle. 2025 May 14;15(1):13.
鄭州大學第一附屬醫院的科研人員探究了杜氏肌營養不良(DMD)動物模型中PIEZO1通道的作用,特別是對肌肉再生和肌纖維損傷的影響。研究發現,PIEZO1在DMD模型的骨骼肌中表達上調,主要在衛星細胞中表達。GsMTx4通過阻斷PIEZO1通道,能夠促進肌生成分化,減輕肌纖維損傷。由AbMole提供的Yoda1(AbMole,M9372)作為PIEZO1通道的激動劑,在實驗中用于對比GsMTx4的效果,以驗證PIEZO1通道在肌生成分化和肌纖維損傷中的作用[9]。

 圖 2. GsMTx4-blocked PIEZO1 channel ameliorates muscular dystrophy in mdx mice[9].
圖 2. GsMTx4-blocked PIEZO1 channel ameliorates muscular dystrophy in mdx mice[9].2. Glia. 2023 May;71(5):1233-1246.
清華大學藥學院、北京眼科研究所的實驗人員探究了Piezo1在視神經(Optic Nerve Head, ONH)星形膠質細胞的細胞周期進程中的作用。研究發現,Piezo1在ONH星形膠質細胞中表達豐富,且對于細胞周期進程至關重要。通過操縱Piezo1的敲低或過表達,研究人員發現Piezo1對于ONH星形膠質細胞的增殖是必要的,但單獨的Piezo1并不足以促進細胞增殖。Piezo1的缺失會導致細胞周期在G0/G1期停滯,可能涉及YAP(Yes-Associated Protein)的核定位的減少和下調受YAP調節的細胞周期相關因子,包括Cyclin D1和c-Myc。此外,通過RNA測序后的GO富集分析表明,Piezo1的缺失影響涉及細胞分裂的生物活動。AbMole的Yoda1(AbMole,M9372)被作為Piezo1通道的特異性激動劑,在實驗中用于激活Piezo1通道,以研究其對ONH星形膠質細胞內鈣信號的影響。

 圖 3. Piezo1activation by Yoda1 regulates intracellular calcium signaling in primary ONH astrocytes[11].
圖 3. Piezo1activation by Yoda1 regulates intracellular calcium signaling in primary ONH astrocytes[11].AbMole是ChemBridge中國區官方指定合作伙伴。


參考文獻
[1] Jerome J. Lacroix, Wesley M. Botello-Smith, Yun Luo, Probing the gating mechanism of the mechanosensitive channel Piezo1 with the small molecule Yoda1, Nature Communications 9(1) (2018) 2029.
[2] Hairong Tang, Ruoqing Zeng, Ende He, et al., Piezo-Type Mechanosensitive Ion Channel Component 1 (Piezo1): A Promising Therapeutic Target and Its Modulators, Journal of Medicinal Chemistry 65(9) (2022) 6441-6453.
[3] B. Coste, J. Mathur, M. Schmidt, et al., Piezo1 and Piezo2 are essential components of distinct mechanically activated cation channels, Science (New York, N.Y.) 330(6000) (2010) 55-60.
[4] S. Wang, R. Chennupati, H. Kaur, et al., Endothelial cation channel PIEZO1 controls blood pressure by mediating flow-induced ATP release, The Journal of clinical investigation 126(12) (2016) 4527-4536.
[5] V. I. Chubinskiy-Nadezhdin, V. Y. Vasileva, I. O. Vassilieva, et al., Agonist-induced Piezo1 activation suppresses migration of transformed fibroblasts, Biochemical and biophysical research communications 514(1) (2019) 173-179.
[6] J. Mao, R. Yang, P. Yuan, et al., Different stimuli induce endothelial dysfunction and promote atherosclerosis through the Piezo1/YAP signaling axis, Archives of biochemistry and biophysics 747 (2023) 109755.
[7] J. Yang, K. Yuan, T. Zhang, et al., Accelerated Bone Reconstruction by the Yoda1 Bilayer Membrane via Promotion of Osteointegration and Angiogenesis, Advanced healthcare materials 12(18) (2023) e2203105.
[8] A. Dolgorukova, J. E. Isaeva, E. Verbitskaya, et al., Differential effects of the Piezo1 agonist Yoda1 in the trigeminovascular system: An electrophysiological and intravital microscopy study in rats, Experimental neurology 339 (2021) 113634.
[9] W. Wang, M. Huang, X. Huang, et al., GsMTx4-blocked PIEZO1 channel promotes myogenic differentiation and alleviates myofiber damage in Duchenne muscular dystrophy, Skeletal muscle 15(1) (2025) 13.
[10] M. Velasco-Estevez, M. Mampay, H. Boutin, et al., Infection Augments Expression of Mechanosensing Piezo1 Channels in Amyloid Plaque-Reactive Astrocytes, Frontiers in aging neuroscience 10 (2018) 332.
[11] Y. Wan, H. Wang, X. Fan, et al., Mechanosensitive channel Piezo1 is an essential regulator in cell cycle progression of optic nerve head astrocytes, Glia 71(5) (2023) 1233-1246.
Copyright(C) 1998-2025 生物器材網 電話:021-64166852;13621656896 E-mail:info@bio-equip.com