國自然熱門領域解析:一文讀懂組蛋白修飾的奧秘
組蛋白修飾是表觀遺傳調控的核心機制之一,通過共價修飾(如甲基化、乙酰化等)改變染色質結構,從而精確調控基因表達,決定細胞的功能和發展方向。作為國家自然科學基金重點支持的研究領域,其分子機制和生物學功能已成為當前生命科學研究的焦點。接下來,我們就來深入了解組蛋白修飾的具體情況。
組蛋白結構
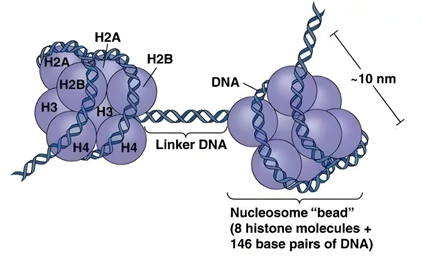
組蛋白是染色質的核心組成成分,其獨特的結構為基因調控奠定了堅實的物質基礎。染色質由DNA與蛋白質組成的復合物,核小體作為染色質的基本結構單元,由147個堿基對的DNA緊密纏繞在組蛋白八聚體上構成。這種結構使得長達數米的DNA能夠有序地壓縮在微米級的細胞核內,為基因的精準調控提供了空間基礎。
組蛋白結構
組蛋白是染色質的核心組成成分,其獨特的結構為基因調控奠定了堅實的物質基礎。染色質由DNA與蛋白質組成的復合物,核小體作為染色質的基本結構單元,由147個堿基對的DNA緊密纏繞在組蛋白八聚體上構成。這種結構使得長達數米的DNA能夠有序地壓縮在微米級的細胞核內,為基因的精準調控提供了空間基礎。
圖片來源于網絡
組蛋白八聚體由兩個H2A、兩個H2B、兩個H3和兩個H4分子組成。在其組裝過程中,H2A與H2B先形成異二聚體,H3與H4亦形成異二聚體,兩個H3-H4二聚體相互結合形成四聚體,隨后兩側各結合一個H2A-H2B二聚體,最終構成穩定的八聚體結構,為DNA提供了穩定的纏繞支架。
值得注意的是,組蛋白存在著豐富的N末端尾巴結構。這些尾巴從核小體的表面伸出,由于缺乏穩定的二級結構,呈現出松散的構象。這種結構特點使得N末端富含的賴氨酸、精氨酸、絲氨酸等氨基酸殘基能夠充分暴露,成為組蛋白修飾的主要靶點。以H3組蛋白為例,其N末端的賴氨酸殘基可發生乙酰化、甲基化等多種修飾,這些修飾事件能夠直接影響染色質的結構動態性與基因的表達活性。
組蛋白修飾常見類型
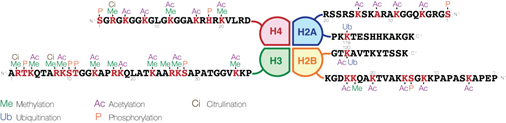
組蛋白修飾是一個高度復雜且精密調控的過程,主要包括乙酰化、甲基化、磷酸化、泛素化等修飾類型。這些修飾事件猶如生物體內的“分子密碼”,通過改變染色質的結構狀態與功能特性,實現對基因表達的精準調控。
值得注意的是,組蛋白存在著豐富的N末端尾巴結構。這些尾巴從核小體的表面伸出,由于缺乏穩定的二級結構,呈現出松散的構象。這種結構特點使得N末端富含的賴氨酸、精氨酸、絲氨酸等氨基酸殘基能夠充分暴露,成為組蛋白修飾的主要靶點。以H3組蛋白為例,其N末端的賴氨酸殘基可發生乙酰化、甲基化等多種修飾,這些修飾事件能夠直接影響染色質的結構動態性與基因的表達活性。
組蛋白修飾常見類型
組蛋白修飾是一個高度復雜且精密調控的過程,主要包括乙酰化、甲基化、磷酸化、泛素化等修飾類型。這些修飾事件猶如生物體內的“分子密碼”,通過改變染色質的結構狀態與功能特性,實現對基因表達的精準調控。
圖片來源于網絡
乙酰化
乙酰化是研究較早且較深入的修飾類型,主要發生在組蛋白N末端的賴氨酸殘基上:
組蛋白乙酰轉移酶( histone acetyltransferase,HAT)負責給賴氨酸殘基加上乙酰基;
而組蛋白去乙酰化酶(histone deacetylase,HDAC)則負責去除乙酰基。
當乙酰基被加上后,賴氨酸殘基的正電荷被中和,DNA與組蛋白之間的靜電引力減弱,染色質結構變得松散,DNA就能更輕松地與轉錄因子等蛋白結合,從而促進基因轉錄。例如,H3組蛋白上K9和K27的乙酰化(H3K9ac和H3K27ac),就常與活性基因的增強子和啟動子“相伴”,在細胞周期調控、增殖和凋亡等過程中發揮關鍵作用。一旦這種平衡被打破,就可能引發疾病。
乙酰化是研究較早且較深入的修飾類型,主要發生在組蛋白N末端的賴氨酸殘基上:
組蛋白乙酰轉移酶( histone acetyltransferase,HAT)負責給賴氨酸殘基加上乙酰基;
而組蛋白去乙酰化酶(histone deacetylase,HDAC)則負責去除乙酰基。
當乙酰基被加上后,賴氨酸殘基的正電荷被中和,DNA與組蛋白之間的靜電引力減弱,染色質結構變得松散,DNA就能更輕松地與轉錄因子等蛋白結合,從而促進基因轉錄。例如,H3組蛋白上K9和K27的乙酰化(H3K9ac和H3K27ac),就常與活性基因的增強子和啟動子“相伴”,在細胞周期調控、增殖和凋亡等過程中發揮關鍵作用。一旦這種平衡被打破,就可能引發疾病。
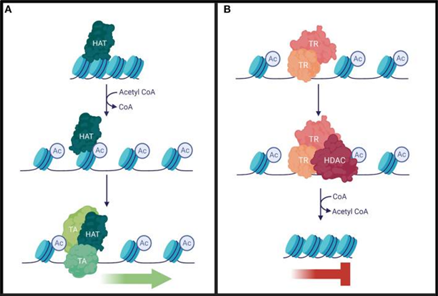
引自Fallah MS, Szarics D, Robson CM, Eubanks JH. Impaired Regulation of Histone Methylation and Acetylation Underlies Specific Neurodevelopmental Disorders. Front Genet. 2021 Jan 8;11:613098.
甲基化
組蛋白甲基化可以發生在賴氨酸或精氨酸殘基上,且修飾位點和修飾程度(單甲基化、雙甲基化、三甲基化)不同,對基因轉錄的影響也各異。與乙酰化改變電荷不同,甲基化并不改變組蛋白的電荷性質。
精氨酸甲基化一般促進轉錄激活,而賴氨酸甲基化既可以與轉錄激活相關,也能參與轉錄抑制:
H3K4me1(組蛋白H3的K4位點單甲基化)通常標記轉錄增強子;
H3K4me3(三甲基化)標記基因啟動子,是基因活化的標志;
而H3的K9和K27位點的三甲基化(H3K9me3和H3K27me3)則是抑制信號。其中H3K27me3在胚胎干細胞中調控發育相關基因的啟動子區域,H3K9me3則在衛星重復序列、端粒等基因貧乏的染色體區域形成異染色質,讓基因“沉默”,它們還會出現在失活的X染色體上,但分布區域有所不同。
組蛋白甲基化修飾由組蛋白甲基轉移酶(histone methyltransferases,HMTs)催化,同時組蛋白去甲基化酶(histone demethylases,HDMs)能夠去除甲基標記,二者共同維持甲基化修飾的動態平衡,實現對基因表達的精細調控。
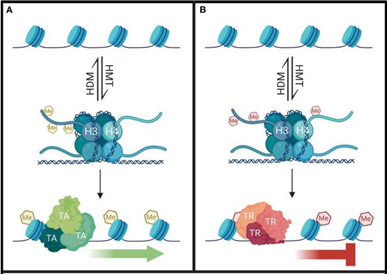
引自Fallah MS, Szarics D, Robson CM, Eubanks JH. Impaired Regulation of Histone Methylation and Acetylation Underlies Specific Neurodevelopmental Disorders. Front Genet. 2021 Jan 8;11:613098.
磷酸化
組蛋白磷酸化在細胞分裂、轉錄調控以及DNA損傷修復等過程中至關重要。所有核心組蛋白上都有可能發生磷酸化,不同的磷酸化位點具有不同的功能。例如,組蛋白H3在絲氨酸10和28上的磷酸化,以及組蛋白H2A在T120上的磷酸化,參與有絲分裂過程中染色質的致密化,調節染色質結構和功能,是細胞周期和生長的重要標志;H2AX在S139處的磷酸化(產生γH2AX)則是DNA雙鏈斷裂后最早發生的事件之一,能夠招募DNA損傷修復蛋白。
與乙酰化和甲基化相比,磷酸化更像是一個“橋梁”,建立其他修飾之間的相互作用,為效應蛋白提供結合平臺,引發下游級聯反應。
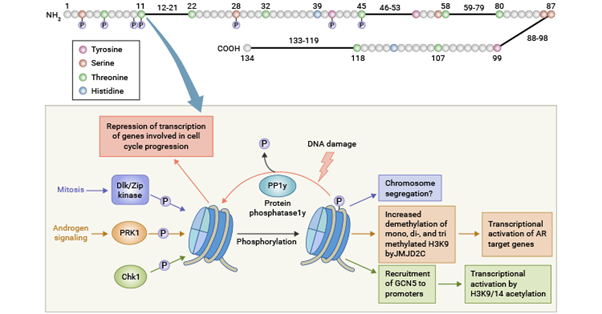
引自Banerjee T, Chakravarti D. A peek into the complex realm of histone phosphorylation. Molecular and Cellular Biology [J]. 2011 Dec;31(24):4858-4873.
泛素化
泛素化修飾主要發生于H2A和H2B組蛋白,是重要的蛋白質翻譯后修飾方式。H2A的泛素化通常與基因沉默相關,其通過改變染色質的三維結構,阻礙轉錄因子與DNA的結合,從而抑制基因表達;而H2B的泛素化則與轉錄激活過程密切相關,能夠促進染色質結構的開放,為轉錄起始復合物的組裝創造條件。此外,在DNA損傷修復過程中,泛素化修飾能夠招募相關修復蛋白,參與損傷識別、信號傳導以及修復執行等多個環節,保障基因組的完整性。
泛素化修飾主要發生于H2A和H2B組蛋白,是重要的蛋白質翻譯后修飾方式。H2A的泛素化通常與基因沉默相關,其通過改變染色質的三維結構,阻礙轉錄因子與DNA的結合,從而抑制基因表達;而H2B的泛素化則與轉錄激活過程密切相關,能夠促進染色質結構的開放,為轉錄起始復合物的組裝創造條件。此外,在DNA損傷修復過程中,泛素化修飾能夠招募相關修復蛋白,參與損傷識別、信號傳導以及修復執行等多個環節,保障基因組的完整性。
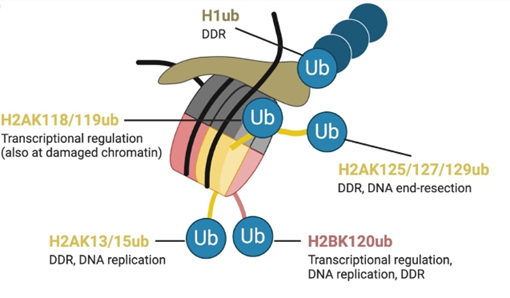
圖片來源于張卿義,張櫻子,沈凱,等.組蛋白泛素化修飾及其在DNA損傷應答中的作用[J].遺傳,2019,41(01):2940.DOl:10.16288/j.yczz.18-112.
組蛋白修飾的“調控鐵三角”
組蛋白修飾的精準調控,離不開這個“書寫者(Writers)-擦除者(Erasers)-閱讀者(Readers)”核心系統。
書寫者(Writers):書寫者酶負責在組蛋白特定氨基酸殘基上添加修飾基團。例如,HAT 家族中的p300/CBP可催化H3和H4多個賴氨酸位點的乙酰化,打開染色質結構,促進基因轉錄;SUV39H1作為HMT家族成員,能夠特異性催化H3K9的甲基化,介導異染色質形成與基因沉默。這些酶往往具有高度的底物特異性和位點選擇性,確保修飾的精準性。
擦除者(Erasers):擦除者酶承擔著去除修飾基團的重要功能,維持修飾水平的動態平衡。HDAC1和HDAC2 可快速去除乙酰化標記,使染色質重新變得緊密,抑制基因表達;JMJD2家族的去甲基化酶則能特異性去除 H3K9me3 等甲基化修飾,逆轉基因沉默狀態。擦除者與書寫者之間的拮抗作用,使得組蛋白修飾處于動態變化之中,以適應細胞不同生理狀態的需求。
閱讀者(Readers):閱讀者蛋白含有特定的結構域,能夠特異性識別并結合修飾后的組蛋白。含溴域的蛋白可識別乙酰化賴氨酸,如BRD4結合H3K27ac后,招募轉錄相關復合物,促進基因轉錄;含chromodomain的蛋白可識別甲基化賴氨酸,像HP1結合H3K9me3后,誘導染色質凝集,實現基因沉默。閱讀者蛋白通過與修飾組蛋白的結合,進一步招募下游效應蛋白,將修飾信號轉化為生物學效應。
組蛋白修飾的精準調控,離不開這個“書寫者(Writers)-擦除者(Erasers)-閱讀者(Readers)”核心系統。
書寫者(Writers):書寫者酶負責在組蛋白特定氨基酸殘基上添加修飾基團。例如,HAT 家族中的p300/CBP可催化H3和H4多個賴氨酸位點的乙酰化,打開染色質結構,促進基因轉錄;SUV39H1作為HMT家族成員,能夠特異性催化H3K9的甲基化,介導異染色質形成與基因沉默。這些酶往往具有高度的底物特異性和位點選擇性,確保修飾的精準性。
擦除者(Erasers):擦除者酶承擔著去除修飾基團的重要功能,維持修飾水平的動態平衡。HDAC1和HDAC2 可快速去除乙酰化標記,使染色質重新變得緊密,抑制基因表達;JMJD2家族的去甲基化酶則能特異性去除 H3K9me3 等甲基化修飾,逆轉基因沉默狀態。擦除者與書寫者之間的拮抗作用,使得組蛋白修飾處于動態變化之中,以適應細胞不同生理狀態的需求。
閱讀者(Readers):閱讀者蛋白含有特定的結構域,能夠特異性識別并結合修飾后的組蛋白。含溴域的蛋白可識別乙酰化賴氨酸,如BRD4結合H3K27ac后,招募轉錄相關復合物,促進基因轉錄;含chromodomain的蛋白可識別甲基化賴氨酸,像HP1結合H3K9me3后,誘導染色質凝集,實現基因沉默。閱讀者蛋白通過與修飾組蛋白的結合,進一步招募下游效應蛋白,將修飾信號轉化為生物學效應。
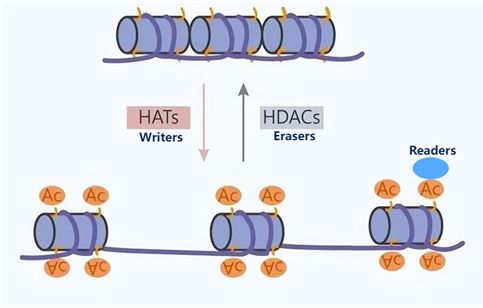
圖片來源于網絡
組蛋白修飾的經典研究技術
染色質免疫沉淀技術(ChIP)是研究組蛋白修飾的經典方法。其基本原理是利用特異性抗體識別并結合帶有特定修飾的組蛋白,通過免疫沉淀的方法分離與組蛋白結合的DNA片段,經純化后可結合qPCR(ChIP-qPCR)或高通量測序(ChIP-seq)進行檢測。ChIP-seq 能在全基因組范圍內精確繪制組蛋白修飾圖譜,大大提高了研究的分辨率和準確性。
近年來,CUT&Tag、CUT&RUN等新興技術在ChIP的基礎上進行優化。相較于傳統ChIP技術,它們在實驗操作上更為簡便,大幅降低了樣本需求量,并且在數據質量上有顯著提升,能夠更高效、靈敏地檢測組蛋白修飾,為組蛋白修飾研究提供了新的高效手段,進一步推動了該領域的研究進展。
參考文獻
[1] Yang X J. The diverse superfamily of histone acetyltransferases and their roles in leukemia and solid tumors[J]. Nucleic Acids Research, 2004, 32(18): 5678-5692.
[2] Bernstein B E, Meissner A, Lander E S. The mammalian epigenome[J]. Cell, 2007, 128(4): 669-681.
[3] Simon J A, Kingston R E. Mechanisms of Polycomb group gene silencing: knowns and unknowns[J]. Nature Reviews Molecular Cell Biology, 2009, 10(11): 697-708.
[4] Cheung P, Tanner K G, Cheung W L, et al. Synergistic methylation and phosphorylation of histone H3 and their role in chromatin transcription[J]. Proceedings of the National Academy of Sciences, 2000, 97(15): 8108-8113.
[5] Rogakou E P, Pilch D R, Orr A H, et al. DNA double - strand breaks induce histone H2AX phosphorylation on serine 139[J]. The Journal of Biological Chemistry, 1998, 273(10): 5858-5868.
[6] Huen M S Y, Grant R, Manke I, et al. MDC1 directly binds phosphorylated histone H2AX to regulate cellular responses to DNA double - strand breaks[J]. The Journal of Cell Biology, 2007, 172(2): 181-193.
[7] van Attikum H, Huen M S Y, Chen J, et al. Recruitment of 53BP1 to DNA damage sites is mediated by interaction with phosphorylated histone H2AX[J]. The Journal of Cell Biology, 2007, 172(2): 131-139.
染色質免疫沉淀技術(ChIP)是研究組蛋白修飾的經典方法。其基本原理是利用特異性抗體識別并結合帶有特定修飾的組蛋白,通過免疫沉淀的方法分離與組蛋白結合的DNA片段,經純化后可結合qPCR(ChIP-qPCR)或高通量測序(ChIP-seq)進行檢測。ChIP-seq 能在全基因組范圍內精確繪制組蛋白修飾圖譜,大大提高了研究的分辨率和準確性。
近年來,CUT&Tag、CUT&RUN等新興技術在ChIP的基礎上進行優化。相較于傳統ChIP技術,它們在實驗操作上更為簡便,大幅降低了樣本需求量,并且在數據質量上有顯著提升,能夠更高效、靈敏地檢測組蛋白修飾,為組蛋白修飾研究提供了新的高效手段,進一步推動了該領域的研究進展。
參考文獻
[1] Yang X J. The diverse superfamily of histone acetyltransferases and their roles in leukemia and solid tumors[J]. Nucleic Acids Research, 2004, 32(18): 5678-5692.
[2] Bernstein B E, Meissner A, Lander E S. The mammalian epigenome[J]. Cell, 2007, 128(4): 669-681.
[3] Simon J A, Kingston R E. Mechanisms of Polycomb group gene silencing: knowns and unknowns[J]. Nature Reviews Molecular Cell Biology, 2009, 10(11): 697-708.
[4] Cheung P, Tanner K G, Cheung W L, et al. Synergistic methylation and phosphorylation of histone H3 and their role in chromatin transcription[J]. Proceedings of the National Academy of Sciences, 2000, 97(15): 8108-8113.
[5] Rogakou E P, Pilch D R, Orr A H, et al. DNA double - strand breaks induce histone H2AX phosphorylation on serine 139[J]. The Journal of Biological Chemistry, 1998, 273(10): 5858-5868.
[6] Huen M S Y, Grant R, Manke I, et al. MDC1 directly binds phosphorylated histone H2AX to regulate cellular responses to DNA double - strand breaks[J]. The Journal of Cell Biology, 2007, 172(2): 181-193.
[7] van Attikum H, Huen M S Y, Chen J, et al. Recruitment of 53BP1 to DNA damage sites is mediated by interaction with phosphorylated histone H2AX[J]. The Journal of Cell Biology, 2007, 172(2): 131-139.
Copyright(C) 1998-2025 生物器材網 電話:021-64166852;13621656896 E-mail:info@bio-equip.com