原代肝細胞-代謝功能障礙相關脂肪性肝炎(MASH)研究的核心模型
關鍵詞:原代肝細胞,代謝性疾病,非酒精性脂肪性肝病,代謝功能障礙相關脂肪性肝炎,非酒精性脂肪性肝炎Primary Hepatocytes, non-alcoholic fatty liver disease(NAFLD), metabolic dysfunction-associated steatohepatitis(MASH),non-alcoholic steatohepatitis(NASH)
代謝功能障礙相關脂肪性肝炎(metabolic dysfunction-associated steatohepatitis,MASH)是一種與代謝紊亂相關的肝臟疾病,早前曾被稱為非酒精性脂肪性肝炎(NASH)。MASH是非酒精性脂肪性肝病( non-alcoholic fatty liver disease,NAFLD)的嚴重形式,極有可能發展為包括肝硬化、肝癌在內的終末期肝病。原代肝細胞(Primary Hepatocytes)作為高度保留體內生理特性的細胞模型,在MASH研究中具有核心應用價值。鑒于此,IPHASE作為體外研究生物試劑引領者,研發生產了MASH供體的原代肝細胞,助力MASH 疾病研究。
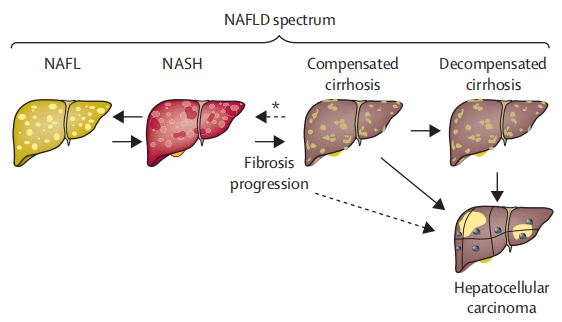
圖片來源:"Non-alcoholic fatty liver disease."The Lancet 397
一、代謝功能障礙相關脂肪性肝炎(MASH)簡介
代謝功能障礙相關脂肪性肝炎(metabolic dysfunction-associated steatohepatitis,MASH)是非酒精性脂肪性肝炎(non-alcoholic steatohepatitis,NASH)的更新命名,更名后能更準確地反映這種疾病與代謝紊亂之間的聯系。MASH與2型糖尿病、高血壓和高血脂等代謝綜合征及肥胖等因素密切相關,已成為全球范圍內的重大健康挑戰。MASH是非酒精性脂肪性肝病(non-alcoholic fatty liver disease, NAFLD)進一步發展的更為嚴重的形式,和單純性非酒精性脂肪肝(NAFL)相比,其發展為肝硬化、肝癌等終末期肝病的風險大大增加,進而導致由肝臟壞死引起的死亡率增加,這也是歐美等發達國家和地區采用肝移植術進行治療的主要原因。MASH常以肝臟脂質大量堆積、脂質代謝紊亂、肝細胞氣球樣變、炎癥和導致纖維化的肝星狀細胞活化為特征。
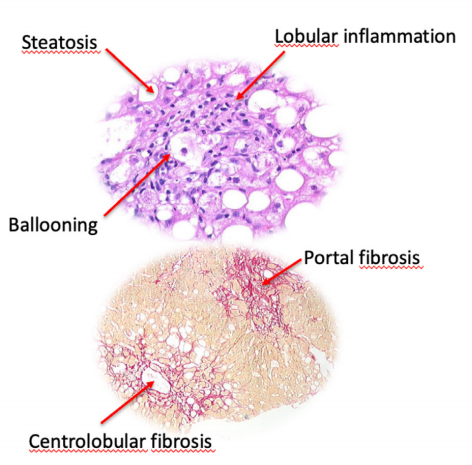
NASH組織學特征(圖片來源:Current therapies and new developments in NASH)
MASH的發病機制復雜,涉及到糖代謝、脂代謝、胰島素抵抗及纖維化等多個方面。患者通常存在胰島素抵抗及相關代謝紊亂,如高膽固醇血癥和高三酰甘油血癥,以及糖代謝調節受損或糖尿病。其可能因素涉及“二次打擊”學說。
1、初次打擊:胰島素抵抗與肝脂肪變
【脂質代謝失衡】
a.脂肪酸攝取增加:肥胖時脂肪組織分解產生的游離脂肪酸(FFA)經門靜脈入肝,超過肝細胞代謝能力。
b.脂肪酸合成亢進:高糖飲食激活SREBP-1c,促進ACC、FASN等酶表達,肝細胞內脂肪酸從頭合成增加。
c.脂質氧化/輸出減少:線粒體功能障礙(如PPARα活性抑制)導致β-氧化效率下降,VLDL組裝缺陷使甘油三酯(TG)滯留。
2、二次打擊:炎癥與纖維化啟動
【氧化應激與脂毒性】
a.過量FFA在線粒體氧化中產生大量活性氧(ROS),誘發脂質過氧化,損傷肝細胞膜及DNA。
b.毒性脂代謝物(如神經酰胺、二酰甘油)激活 PKC、JNK通路,抑制胰島素信號。
【炎癥信號級聯】
a.脂滴破裂釋放的FFA激活 TLR4/NF-κB通路,誘導TNF-α、IL-6等促炎因子分泌,招募巨噬細胞(Kupffer細胞)形成炎癥灶。
b.NLRP3炎癥小體激活,釋放IL-1β、IL-18,加劇肝細胞損傷。
【肝纖維化形成】
a.持續炎癥激活肝星狀細胞(HSCs),使其從靜息態轉化為肌成纖維細胞,分泌 I、III型膠原,形成纖維間隔。
MASH不僅極有可能發展為肝硬化和肝癌等終末期肝病,還對全身多個系統均有影響,例如心血管系統、消化系統、呼吸系統等。目前,MASH的治療主要依賴于生活方式的改變,主要是減重,其藥物研發并不順利,主要原因歸結為MASH復雜的發病機制以及診斷障礙為相關藥物研究帶來了極大挑戰。合適的體外模型對于MASH的發病機制及相關藥物研發研究至關重要。
二、原代肝細胞與MASH研究
原代肝細胞(Primary Hepatocytes)是指從動物肝臟直接分離的天然細胞,因其保留體內肝臟的代謝功能與基因表達譜,成為MASH發病機制、藥物篩選及治療靶點驗證研究的核心模型。
1、原代肝細胞在MASH研究中的優勢
【代謝功能完整性】保留糖原合成、脂肪酸β-氧化、膽汁酸代謝等關鍵通路(如CYP7A1介導的膽固醇轉化)。
【信號通路真實性】胰島素信號(IRS-PI3K-AKT)、核受體調控(PPARα/γ、FXR)等與體內一致。
【病理模型相關性】可模擬肝細胞脂肪變、炎癥及纖維化信號的級聯反應,而細胞系常缺失關鍵病理特征。
2、原代肝細胞構建MASH體外模型
【脂質過載模型】通過FFA混合物和高糖刺激,可以模擬肝脂肪變性。
【炎癥-纖維化模型】通過脂毒性、炎癥因子和纖維化信號聯合刺激,可以模擬MASH進展。
【代謝綜合征共病模型】通過胰島素抵抗和氧化應激等多因素干預,可模擬臨床復雜性。
通過原代肝細胞構建MASH體外模型,研究人員可進行脂毒性信號通路解析、線粒體功能研究、藥物代謝與毒性評估等關鍵MASH機制的探索,為MASH相關藥物篩選與研發提供有力的數據支持。
3、原代肝細胞模型研究挑戰與發展方向
【技術挑戰】
a.細胞活性維持:原代肝細胞體外存活時間短,需優化培養條件。
b.個體差異:供體遺傳背景、代謝狀態差異影響結果一致性。
c.細胞互作:單一細胞模型缺乏肝內非實質細胞(如Kupffer細胞、星狀細胞)的交互作用,難以完全模擬體內炎癥微環境。
【模型進階策略】
a.多細胞共培養:加入肝星狀細胞、Kupffer細胞構建更接近體內的微環境,復現MASH中的細胞互作。
b.3D球狀體或類器官培養:增強細胞間接觸,模擬更真實的體內環境,延長培養周期。
c.微流控器官芯片(Liver-on-a-Chip):整合血流動力學刺激,在微流控裝置中實現長期藥物代謝模擬。
綜上所述,原代肝細胞作為最接近體內生理狀態的MASH研究模型,在其機制解析、藥物研發中具有不可替代的價值。通過優化培養體系與結合新興技術(如3D培養、器官芯片),其應用正從單一細胞功能研究向系統性病理模型拓展,為MASH的精準治療提供關鍵實驗依據。
三、IPHASE相關產品
然而,獲取高質量MASH供體的原代肝細胞面臨技術分離與供體資源合規的雙重挑戰,需通過優化分離流程、標準化供體篩選及遵守法規協同解決。IPHASE作為體外研究生物試劑引領者,不斷開拓創新、銳意進取,突破MASH研究瓶頸,攻克分離技術與倫理合規壁壘。在原代肝細胞分離技術方面,IPHASE科研人員采用目前國際上流行的兩步膠原酶灌流法(Seglen灌流法)的原代肝細胞分離方法,并根據MASH肝組織特性進行分離技術改良,可以分離得到高純度和高活性的MASH供體原代肝細胞。在供體資源倫理合規方面,IPHASE具有豐富的樣本資源庫,MASH供體經嚴格篩選,來源清晰,并經合規性評定,有倫理和知情,免除了后顧之憂。
IPHASE通過技術創新與資源整合構建的雙護城河,不僅解決了MASH原代肝細胞的獲取難題,更形成了從基礎研究到藥物研發的全鏈條服務能力。在MASH藥物研發管線持續擴容的背景下,該模式有望成為連接基礎研究與臨床轉化的核心基礎設施,為代謝性疾病領域的突破提供關鍵支撐。