纖維肌痛患者菌群移植可誘發小鼠疼痛超敏的研究
纖維肌痛(FM)作為一種神秘慢性疼痛綜合征,困擾全球數億人群,其病因長期成謎。最新突破性研究發現,FM患者的腸道菌群竟能直接向神經系統發射"疼痛信號"——移植患者菌群的小鼠不僅出現疼痛超敏,更重現了免疫激活、代謝紊亂等人類病理特征!這項研究首次證實腸道菌群是FM疼痛的核心驅動者,為改寫"無損傷性疼痛"的治療范式點燃希望。

研究思路
面對"無組織損傷的全身疼痛如何產生"這一難題,研究團隊設計了三步破解策略:首先通過無菌小鼠模型移植FM患者菌群,排除宿主干擾驗證菌群的因果作用;繼而采用多組學聯用技術(單細胞測序+代謝組學+神經成像)捕捉菌群誘導的免疫-代謝-神經三重風暴;最后通過菌群置換療法(抗生素清除+健康菌群移植)實現疼痛逆轉,并在人類患者中開展開放性臨床試驗,最終繪制出"菌群-膽汁酸-小膠質細胞-疼痛"的完整信號軸。
研究方法及結果
1.FM患者腸道菌群紊亂與代謝失調
研究內容:對比纖維肌痛(FM)患者與健康人腸道菌群組成及血清代謝物。
研究結果:
致病菌異常增殖:腸道內肺炎克雷伯菌(K. aerogenes)等促炎菌群顯著增加
保護菌嚴重缺失:產有益代謝物的菌群(如Faecalibacterium)豐度大幅下降
循環致痛因子累積:血清中毒性代謝物咪唑丙酸(IPA)水平明顯升高,且與疼痛程度呈正相關趨勢
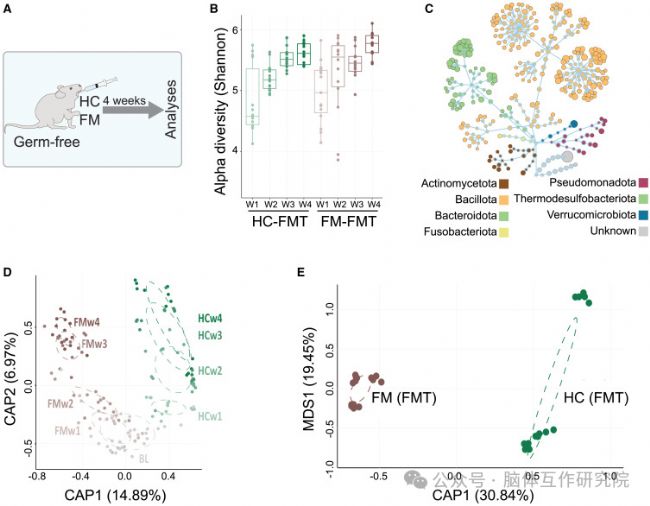
圖1 FM患者腸道菌群與代謝物失衡
2.移植FM菌群誘發疼痛超敏
研究內容:將FM患者菌群移植至無菌小鼠體內。
研究結果:
行為學表型復制:小鼠出現持續性機械痛覺超敏與熱痛覺敏感
脊髓免疫激活:脊髓背角星形膠質細胞與小膠質細胞顯著活化,神經炎癥微環境形成
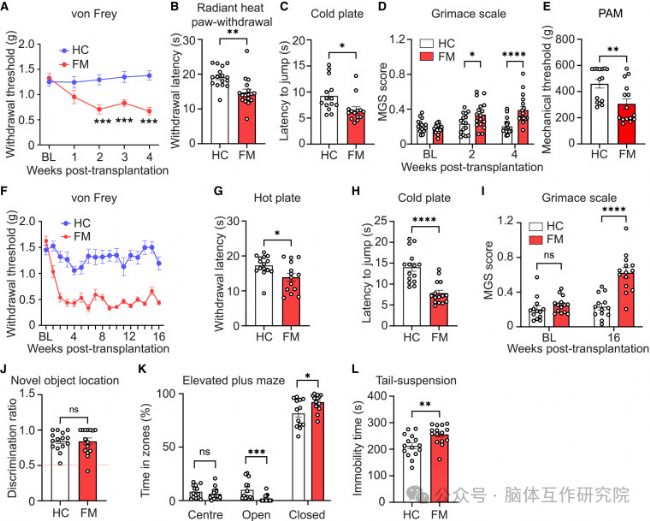
圖2 菌群移植成功構建FM疼痛模型
3.肺炎克雷伯菌通過LPS直接驅動疼痛
研究內容:單一定植K. aerogenes至無菌小鼠并清除LPS干預。
研究結果:
病原菌致病性確認:定植該菌足以誘發疼痛敏感性增強
內毒素核心作用:清除LPS后疼痛行為顯著緩解,證實其作為關鍵毒性介質
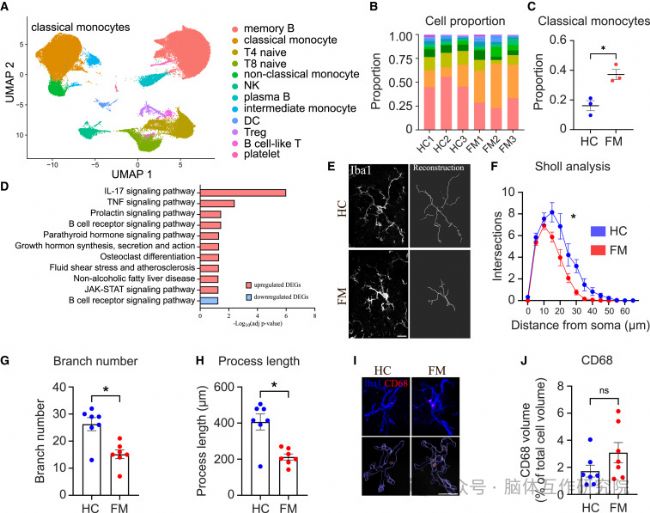
圖3 K. aerogenes依賴LPS介導疼痛
4.代謝物IPA敏化傷害性神經元
研究內容:解析IPA對背根神經節(DRG)神經元興奮性的影響。
研究結果:
離子通道調控:IPA增強電壓門控鈉通道Nav1.8電流強度
神經元超興奮:DRG神經元鈣信號活動頻率顯著加快
遺傳學驗證:Nav1.8基因缺失完全阻斷IPA的致痛效應
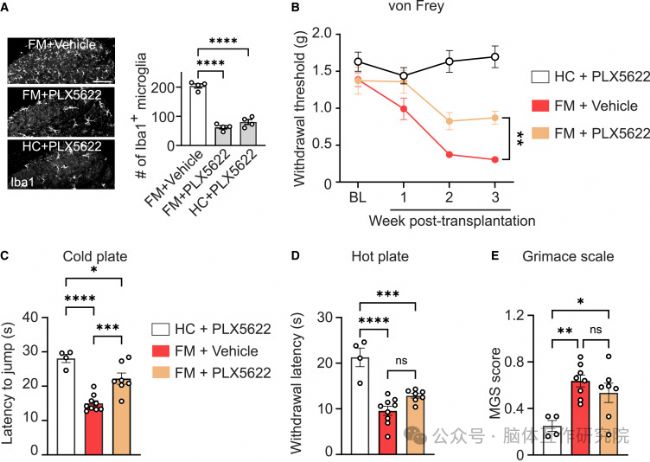
圖4 IPA通過Nav1.8通道致神經元超敏化
5.TLR4通路介導中樞神經炎癥
研究內容:使用TLR4拮抗劑阻斷FM模型小鼠信號通路。
研究結果:
疼痛行為逆轉:TLR4抑制后機械痛閾明顯改善
膠質細胞靜息:脊髓星形膠質細胞與小膠質細胞活化狀態顯著受抑
炎癥因子下調:促炎因子IL-1β等表達量大幅降低
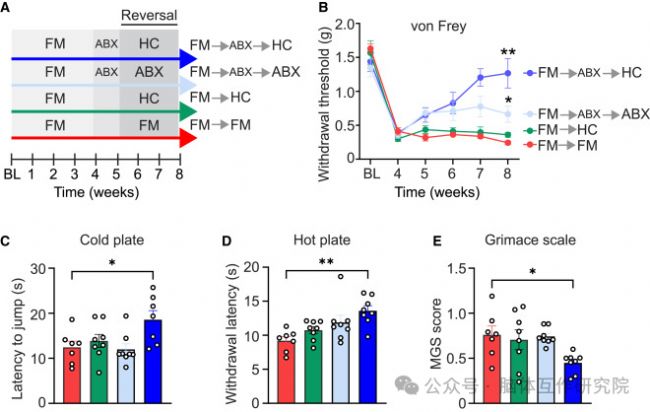
圖5 TLR4信號驅動神經炎癥性疼痛
6.益生菌多靶點治療效應
研究內容:補充共生菌Faecalibacterium prausnitzii(F. prau)干預FM模型。
研究結果:
鎮痛作用:疼痛行為學指標全面改善
腸屏障修復:結腸上皮緊密連接蛋白表達增強
抗炎協同:脊髓促炎因子釋放顯著減少,腸道有益代謝物增加
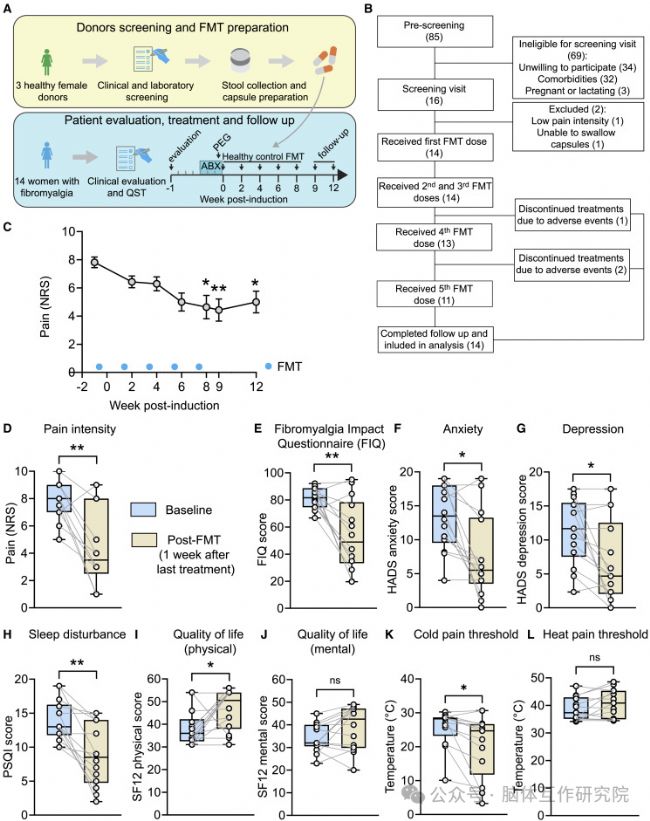
圖6 F. prau通過腸-腦軸多機制緩解疼痛
研究結論
本研究首次鎖定腸道菌群為纖維肌痛疼痛的核心驅動者:FM菌群通過"三重打擊機制"——①膽汁酸代謝紊亂削弱內源性鎮痛屏障、②小膠質細胞活化放大脊髓疼痛信號、③表皮神經重塑降低痛覺閾值——共同引爆全身疼痛風暴。更關鍵的是,研究證實健康菌群移植可重置疼痛回路,為FM提供首個靶向腸-腦軸的治療方案。基于此,菌群-膽汁酸-小膠質細胞軸成為黃金干預靶點:口服膽汁酸類似物(如UDCA)可快速緩解疼痛,糞菌移植療法則有望從根源改寫疾病進程。這項發現不僅破解了"無損傷性疼痛"的百年謎題,更開創了神經免疫代謝交互研究的新紀元。
參考文獻:
Devlin BA, Nguyen DM, Ribeiro D, Grullon G, Clark MJ, Finn A, Ceasrine AM, Oxendine S, Deja M, Shah A, Ati S, Schaefer A, Bilbo SD. Excitatory-neuron-derived interleukin-34 supports cortical developmental microglia function. Immunity. 2025 Jun 26:S1074-7613(25)00249-3. doi: 10.1016/j.immuni.2025.06.002. Epub ahead of print. PMID: 40609535.
創作聲明:本文是在原英文文獻基礎上進行解讀,存在觀點偏向性,僅作分享,請參考原文深入學習。


想了解更多內容,獲取相關咨詢請聯系
電 話:+86-0731-84428665
伍經理:+86-180 7516 6076
徐經理:+86-138 1744 2250
郵 箱:consentcs@163.com