應用QCM-D揭示靜電-疏水協(xié)同納米伴侶增強蛋白質折疊調(diào)控
用戶成果|中國醫(yī)學科學院黃帆/南開大學史林啟團隊JACS:應用QCM-D揭示靜電-疏水協(xié)同納米伴侶增強蛋白質折疊調(diào)控

背景知識
蛋白質的正確折疊是維持其結構與功能的核心過程,但折疊過程中易發(fā)生錯誤,導致聚集或功能喪失。分子伴侶(如天然Spy蛋白)通過靜電吸引和疏水作用協(xié)同調(diào)控蛋白質折疊,但其應用受限于電荷單一性、結構脆弱性及環(huán)境敏感性。針對這一挑戰(zhàn),近日中國醫(yī)學科學院黃帆/南開大學史林啟團隊以“Natural Spy Chaperone Mimic: Tailored Nanochaperone with Electrostatic–Hydrophobic Synergy To Enhance Protein Folding Regulation”為題,在《Journal of the American Chemical Society》上發(fā)表相關研究成果,在這項研究中, 研究團隊受天然Spy蛋白啟發(fā),設計了一種多功能仿生納米伴侶(nChap),通過靜電-疏水協(xié)同作用增強蛋白質折疊調(diào)控能力,突破天然伴侶的局限。
研究方法
實驗結果與分析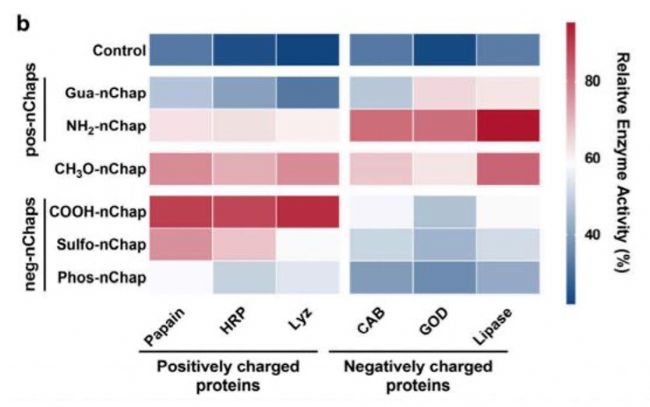
在80°C高溫下,nChap使多種酶的殘余活性提升50%以上。
圓二色光譜(CD)和熒光分析表明,nChap有效恢復熱變性蛋白的二級/三級結構。
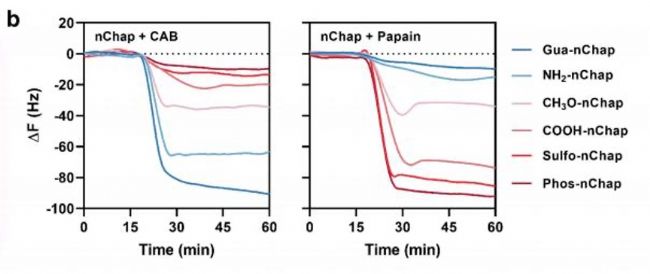
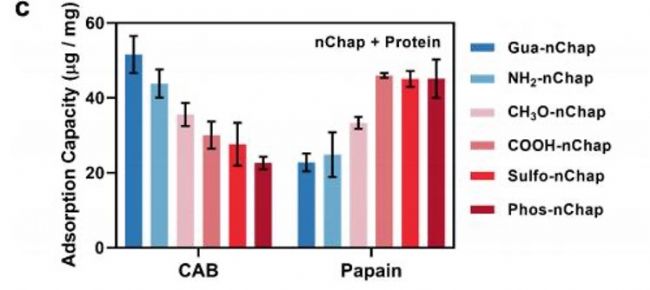
QCM-D數(shù)據(jù)顯示:帶正電的Gua-nChap對負電蛋白CAB吸附量達51.6 μg/mg,而帶負電的Phos-nChap對正電木瓜蛋白酶的吸附量更高(45.1 μg/mg),證實電荷互補增強結合。
熒光共振能量轉移(FRET)和靜態(tài)光散射(SLS)進一步證明,靜電作用引導蛋白進入nChap疏水微區(qū),抑制聚集。
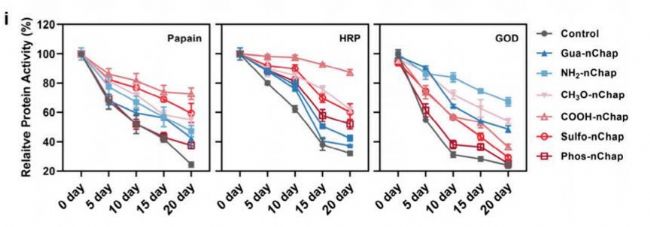
在40°C下儲存20天,nChap使多種蛋白活性損失降低40%-60%。
成功應用于9種不同等電點(pI)和分子量的蛋白質,展現(xiàn)優(yōu)于天然Spy的普適性。
結論與展望
該研究通過仿生設計提出了一種新型納米伴侶策略,兼具電荷可調(diào)性、多重疏水微區(qū)及環(huán)境穩(wěn)定性,顯著提升蛋白質折疊調(diào)控效率。QCM-D技術為解析靜電-疏水協(xié)同機制提供了關鍵數(shù)據(jù)支持。未來,nChap有望在生物醫(yī)藥領域(如蛋白質藥物儲存、疾病相關蛋白聚集治療)中發(fā)揮重要作用,并為人工伴侶系統(tǒng)的開發(fā)提供新范式。
基金支持
國家自然科學基金(52293380、52073306等)、國家重點研發(fā)計劃(2022YFA1205700)、天津市自然科學基金(23JCZDJC00160)、中國醫(yī)學科學院醫(yī)學與健康科技創(chuàng)新工程(2022-I2M-2-003)。
原文鏈接
https://doi.org/10.1021/jacs.5c01133

背景知識
蛋白質的正確折疊是維持其結構與功能的核心過程,但折疊過程中易發(fā)生錯誤,導致聚集或功能喪失。分子伴侶(如天然Spy蛋白)通過靜電吸引和疏水作用協(xié)同調(diào)控蛋白質折疊,但其應用受限于電荷單一性、結構脆弱性及環(huán)境敏感性。針對這一挑戰(zhàn),近日中國醫(yī)學科學院黃帆/南開大學史林啟團隊以“Natural Spy Chaperone Mimic: Tailored Nanochaperone with Electrostatic–Hydrophobic Synergy To Enhance Protein Folding Regulation”為題,在《Journal of the American Chemical Society》上發(fā)表相關研究成果,在這項研究中, 研究團隊受天然Spy蛋白啟發(fā),設計了一種多功能仿生納米伴侶(nChap),通過靜電-疏水協(xié)同作用增強蛋白質折疊調(diào)控能力,突破天然伴侶的局限。
研究方法
- 納米伴侶的理性設計
nChap由疏水性聚己內(nèi)酯(PCL)內(nèi)核和親水性聚乙二醇(PEG)/pH響應性聚β-氨基酯(PAE)混合殼層組成。通過修飾不同末端基團(氨基、羧基等),調(diào)控表面電荷特性,模擬Spy的電荷分布。
- QCM-D技術的關鍵作用
研究采用QSense耗散型石英晶體微天平(QCM-D)實時監(jiān)測nChap與蛋白質的結合動力學。通過頻率變化(ΔF)定量分析不同電荷nChap對正/負電性蛋白(如CAB、木瓜蛋白酶)的吸附能力,揭示靜電相互作用的主導地位。
實驗結果與分析
- 熱應激下蛋白質穩(wěn)定性的顯著提升

在80°C高溫下,nChap使多種酶的殘余活性提升50%以上。
圓二色光譜(CD)和熒光分析表明,nChap有效恢復熱變性蛋白的二級/三級結構。
- 靜電-疏水協(xié)同機制驗證


QCM-D數(shù)據(jù)顯示:帶正電的Gua-nChap對負電蛋白CAB吸附量達51.6 μg/mg,而帶負電的Phos-nChap對正電木瓜蛋白酶的吸附量更高(45.1 μg/mg),證實電荷互補增強結合。
熒光共振能量轉移(FRET)和靜態(tài)光散射(SLS)進一步證明,靜電作用引導蛋白進入nChap疏水微區(qū),抑制聚集。
- 長期穩(wěn)定性與廣譜適用性

在40°C下儲存20天,nChap使多種蛋白活性損失降低40%-60%。
成功應用于9種不同等電點(pI)和分子量的蛋白質,展現(xiàn)優(yōu)于天然Spy的普適性。
結論與展望
該研究通過仿生設計提出了一種新型納米伴侶策略,兼具電荷可調(diào)性、多重疏水微區(qū)及環(huán)境穩(wěn)定性,顯著提升蛋白質折疊調(diào)控效率。QCM-D技術為解析靜電-疏水協(xié)同機制提供了關鍵數(shù)據(jù)支持。未來,nChap有望在生物醫(yī)藥領域(如蛋白質藥物儲存、疾病相關蛋白聚集治療)中發(fā)揮重要作用,并為人工伴侶系統(tǒng)的開發(fā)提供新范式。
基金支持
國家自然科學基金(52293380、52073306等)、國家重點研發(fā)計劃(2022YFA1205700)、天津市自然科學基金(23JCZDJC00160)、中國醫(yī)學科學院醫(yī)學與健康科技創(chuàng)新工程(2022-I2M-2-003)。
原文鏈接
https://doi.org/10.1021/jacs.5c01133
Copyright(C) 1998-2025 生物器材網(wǎng) 電話:021-64166852;13621656896 E-mail:info@bio-equip.com