轉(zhuǎn)錄因子ERG調(diào)節(jié)微血管系統(tǒng)中低剪切應(yīng)力誘導的抗血栓途徑
止血是一種生理機制,旨在通過在受傷后形成血凝塊來維持血管完整性。一個健康內(nèi)皮細胞的重要功能是通過對許多促凝和抗凝基因的精細調(diào)控來維持一個基本的抗血栓狀態(tài)。在由內(nèi)皮細胞 (EC) 控制的多種促凝和抗凝途徑中,血栓調(diào)節(jié)蛋白 (TM) 是調(diào)節(jié)凝血和血栓形成的關(guān)鍵參與者。根據(jù)其抗凝和抗炎作用,TM與多種炎癥和缺血性病理有關(guān),如靜脈血栓栓塞、出血性疾病、冠狀動脈疾病和動脈粥樣硬化等。
先前的研究表明,不同的外部刺激能夠轉(zhuǎn)錄調(diào)節(jié) TM。層流剪切應(yīng)力 (SS) 已被證明上調(diào) TM 表達,而炎癥細胞因子如 TNF-α 通過轉(zhuǎn)錄因子 (TF) NF-κB 抑制 TM 表達。多個 TF 參與了TM表達的調(diào)控,包括 Krüppel 樣因子 2 (KLF2)。KLF2 已被證明可以在靜態(tài)、低SS 和高SS 條件下調(diào)節(jié) EC 中的 TM 水平。由KLF2介導的高SS上調(diào)TM表達,這是大動脈中重要的保護性抗血栓和抗動脈粥樣硬化的機制。
然而,與內(nèi)皮細胞TM的缺失不同,小鼠體內(nèi) KLF2 的缺失導致 TM 表達的適度降低,并不足以引起自發(fā)性血栓形成,這表明 KLF2 需要與其他 TF 合作來調(diào)節(jié) TM 水平并發(fā)揮其抗血栓作用,可能是在選定的血管床上。
TF ETS-related gene (ERG) 是成人分化EC中E-26轉(zhuǎn)化特異性(ETS)家族中最豐富的成員,在所有血管床中都有表達。多項研究已經(jīng)描述了 ERG 在內(nèi)皮中的重要作用,比如調(diào)節(jié)血管發(fā)育和血管生成、促進血管穩(wěn)態(tài)、抑制健康內(nèi)皮細胞中的血管炎癥等。
基于此,來自英國帝國理工學院國家心肺研究所、美國賓夕法尼亞大學醫(yī)學院藥理學系等領(lǐng)域的研究團隊在 Nature Communications 上發(fā)表了題為《The transcription factor ERG regulates a low shear stress-induced anti-thrombotic pathway in the microvasculature》的文章。鑒于ERG的多重穩(wěn)態(tài)功能,該實驗假設(shè)ERG可能在EC中具有抗血栓作用,從而保護血管免受自發(fā)性血栓的形成。
實驗結(jié)果:
首先,為了研究ERG發(fā)揮其抗血栓作用的分子機制,實驗使用了可誘導內(nèi)皮缺失ERG (Erg iEC-KO )的成年小鼠。最后數(shù)據(jù)表明,在選定的血管床中,內(nèi)皮TF ERG是防止自發(fā)性血栓形成的關(guān)鍵。ERG的缺失破壞了凝血的調(diào)節(jié),導致肝和肺中與血栓和/或出血相關(guān)的凝血病。
其次,為了研究 ERG 發(fā)揮其抗血栓功能的分子機制,分析了 ERG 缺失的 HUVEC 的全局轉(zhuǎn)錄組譜,并確定了多個直接或間接參與凝血調(diào)節(jié)的基因作為ERG 的轉(zhuǎn)錄靶點。這些基因在 HUVEC 中進行了 qPCR 驗證。最后發(fā)現(xiàn)表明, ERG 可能以組織特異性的方式調(diào)節(jié)多種促凝和抗凝基因,并指出 TM 是 ERG 抗血栓作用的關(guān)鍵候選基因。
然后,為了測試在Erg iEC-KO 小鼠中觀察到的血栓表型是否是由于TM 表達的減少,實驗使用了靶向紅細胞 (RBC-TM) 的小鼠重組 TM 融合蛋白來恢復體內(nèi) TM 蛋白的活性。最后數(shù)據(jù)表明,用 RBC-TM 進行急性治療能夠顯著挽救在Erg iEC-KO小鼠中觀察到的凝血功能障礙。
接下來,實驗使用體外模型來研究 ERG 控制 TM 表達的機制。通過免疫印跡(圖1 b、c,圖2 b ) 和IF顯微鏡(圖1 d、e )檢測,與對照組siRNA相比,siRNA處理12、24 和 48h 抑制了HUVEC中 ERG表達,可導致TM mRNA(圖1 a和圖2 a)和蛋白表達下降。
ERG 還在人真皮微血管 EC(HDMEC)(圖1 d和圖2 d)和人真皮血液EC(HDBEC)(圖1 e)中調(diào)節(jié)微血管 EC 中 mRNA 和蛋白質(zhì)水平的 TM 表達 。相反,ERG 過表達(圖2 e、f)顯著增加了 HUVEC 中的TM表達(圖1 f)。
TM 是凝血酶介導的天然抗凝劑 APC 5激活的關(guān)鍵調(diào)節(jié)劑。為了研究 ERG 對 TM 表達的調(diào)控是否導致其功能的調(diào)控,實驗對用 ERG siRNA 處理的 HUVEC 進行了蛋白 C 激活測定,并測量了APC 隨時間的產(chǎn)生。與降低的 TM 表達一致,ERG 缺失細胞(圖2 g,h)在與蛋白 C 孵育 30 分鐘后顯示出APC 的產(chǎn)生減少,與 siCtrl 細胞相比,在60 min時間點APC的生成減少最大(圖1 g)。
這些結(jié)果表明 ERG 調(diào)節(jié) TM 水平,從而調(diào)節(jié) EC 中的 TM-蛋白 C 系統(tǒng)。
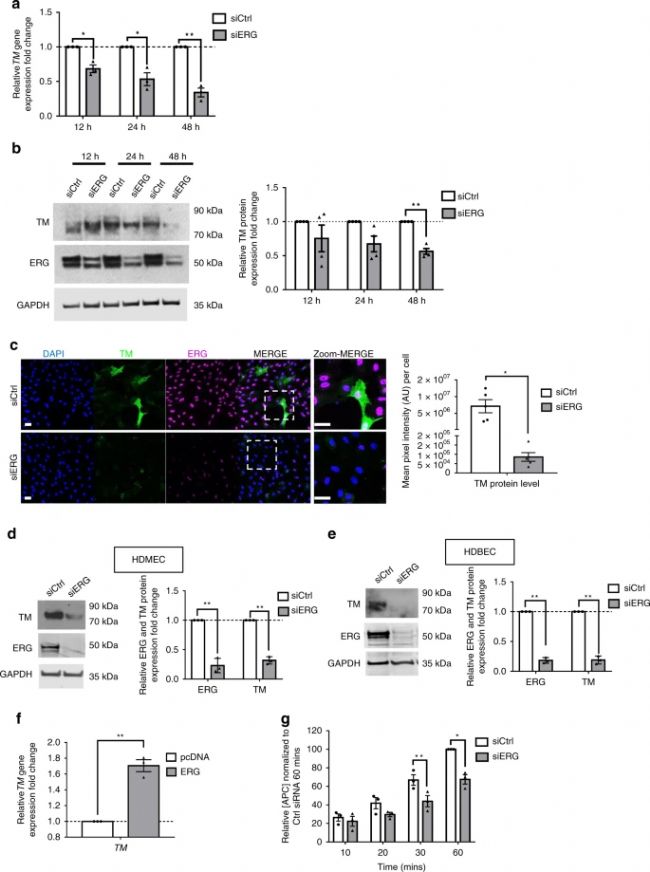
圖 1
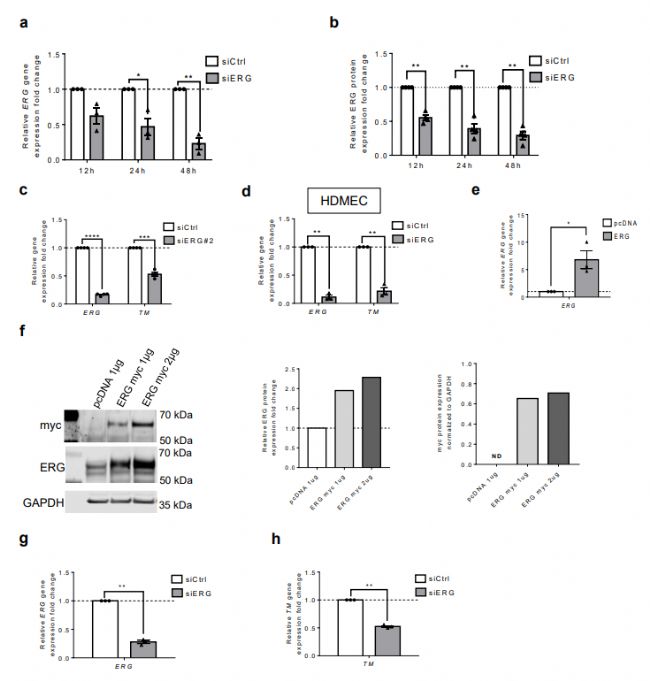
圖 2
在體外,實驗證明 ERG 與TM啟動子結(jié)合并轉(zhuǎn)化,并確定了一個ERG-KLF2 復合物,它協(xié)同驅(qū)動TM的表達;ERG 促進 KLF2 染色質(zhì)進入、DNA 結(jié)合和TM 啟動子的反式激活。
盡管在體外靜態(tài)條件下,KLF2和TM在EC中表達,但它們是重要的血流響應(yīng)基因:層流剪切應(yīng)力(SS)上調(diào)KLF2的表達,進而促進TM的表達增加。但是,ERG是否是一個血流響應(yīng)型TF尚不清楚。
接下來,實驗首先研究了低(5 dynes per cm2)和高(20 dynes per cm2)層流SS對HUVEC中ERG和KLF2蛋白水平的影響。正如預期的那樣,與靜態(tài)條件相比,暴露于低 SS和高 SS 的 HUVEC 中 KLF2 蛋白水平上調(diào),相反,ERG 蛋白水平不受 SS 的影響(圖3 a)。與靜態(tài)條件相比,在低 SS 條件下 ERG-KLF2 復合物的形成增加,高 SS 沒有進一步增加這種相互作用(圖3 b)。
然后研究了 ERG 在使用 ERG 或?qū)φ?siRNA 處理的 HUVEC中,在靜態(tài)、低SS 、高 SS 條件下,在調(diào)節(jié)TM 表達中的作用。正如預期的那樣,與靜態(tài)條件相比,暴露于 SS 的 HUVEC 中KLF2和TM mRNA 水平上調(diào),而ERG mRNA 水平不受影響(圖3 c)。
重要的是,雖然高SS誘導了在ERG缺失細胞中TM表達的上調(diào),但低SS無法誘導其上調(diào)(圖3 c),表明ERG在低 SS 條件下選擇性地控制TM的表達,并且它對于高SS依賴性的TM調(diào)控是不可缺少的。
這些結(jié)果表明,ERG 和 KLF2 之間的合作對于 TM 在低 SS 條件下的表達是必不可少的,并表明其在高SS條件下,有其他基因/通路支持KLF2依賴性轉(zhuǎn)錄。
HUVEC 是體外使用最廣泛的 EC 模型,但不能概括來自不同血管床的 EC 的所有特性。因此,為了研究 ERG 在微血管或動脈來源的 EC 中 TM 的調(diào)節(jié)作用,實驗還對人微血管 EC(HDBEC)(圖3 d)和人主動脈內(nèi)皮細胞(HAEC)進行了流動實驗。與 HUVEC 相比,HDBEC 實驗顯示出相似的結(jié)果,表明ERG在低SS條件下特異性調(diào)節(jié)TM的表達,在微血管EC中也是如此(圖3 d)。
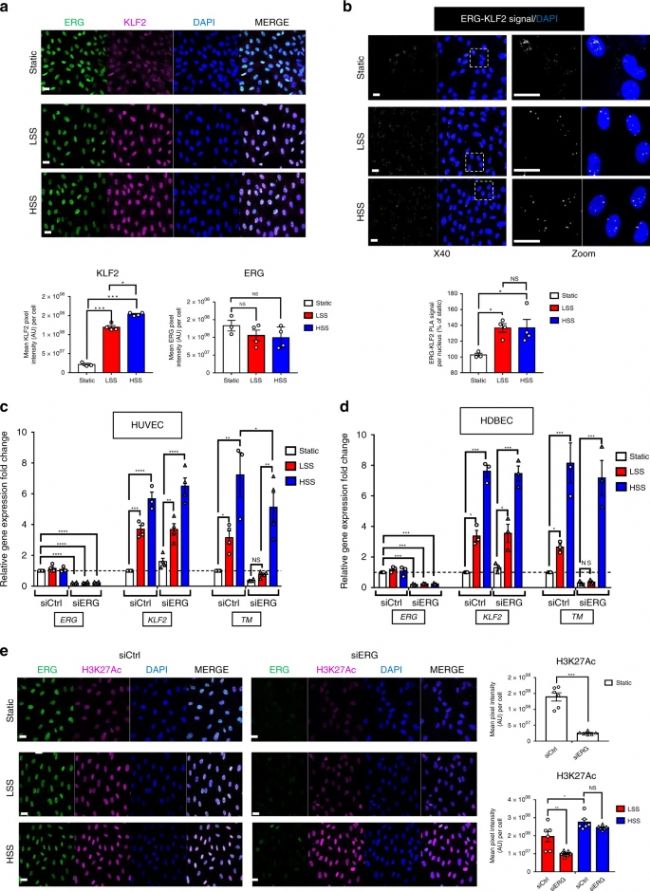
圖 3
最后,實驗還發(fā)現(xiàn),ERG 在暴露于低 SS 的微血管床中特異性調(diào)節(jié) TM的 表達,但在暴露于高SS 的血管(主動脈)EC 中則不然。
實驗結(jié)論:
總之,研究表明 ERG 對于維持內(nèi)皮抗血栓環(huán)境至關(guān)重要。實驗證明 ERG 是 TM 的直接轉(zhuǎn)錄調(diào)節(jié)因子,通過與 KLF2 合作以特定的方式驅(qū)動其表達。
鑒于血栓性疾病對特定器官的血管床表現(xiàn)出選擇性偏好,血管床特異性通路的識別對人類病理具有潛在的重要意義。該途徑可能參與與微血管血栓形成和/或凝血病相關(guān)的人類疾病的發(fā)病機制,例如彌散性血管內(nèi)凝血、溶血性尿毒癥綜合征或敗血癥。
參考文獻:
Peghaire C, Dufton NP, Lang M, Salles-Crawley II, Ahnström J, Kalna V, Raimondi C, Pericleous C, Inuabasi L, Kiseleva R, Muzykantov VR, Mason JC, Birdsey GM, Randi AM. The transcription factor ERG regulates a low shear stress-induced anti-thrombotic pathway in the microvasculature. Nat Commun. 2019 Nov 1;10(1):5014. doi: 10.1038/s41467-019-12897-w. PMID: 31676784; PMCID: PMC6825134.
小編旨在分享、學習、交流生物科學等領(lǐng)域的研究進展。如有侵權(quán)或引文不當請聯(lián)系小編修正。微信搜索公眾號“Naturethink”,學習更多關(guān)于流體機械力學刺激細胞培養(yǎng)相關(guān)知識吧!