AlphaFold(AF) 不能替代基于實驗的蛋白質(zhì)結(jié)構(gòu)解析的原因分析
文章原創(chuàng): 豬豬俠愛科學 文章來源:蛋白動態(tài)
AlphaFold (AF) 預測的很多蛋白結(jié)構(gòu)已達到甚至有些超過實驗精度,但AF還遠遠不能取代實驗對所有蛋白質(zhì)結(jié)構(gòu)進行精準預測。常見的原因如下:
1. 有的天然無序蛋白在溶液中不存在單一的穩(wěn)定的結(jié)構(gòu)狀態(tài),而AF預測其有結(jié)構(gòu)(一般為結(jié)合底物后的結(jié)構(gòu)),出現(xiàn)“假陽性”結(jié)果,如突觸核蛋白(α-synuclein);
2. AF無法預測點突變?nèi)缗c疾病相關(guān)的突變體以及翻譯后修飾對蛋白造成的結(jié)構(gòu)擾動;
3. AF無法預測周圍環(huán)境因素如膜環(huán)境對蛋白可能造成的結(jié)構(gòu)影響,因此不能準確預測一些膜蛋白的結(jié)構(gòu);
4. AF無法預測蛋白結(jié)合底物后的構(gòu)象變化;
5. AF無法預測蛋白質(zhì)在溶液中存在的不同構(gòu)象;
6. AF預測的蛋白結(jié)構(gòu)loop區(qū)域一般準確度較低;
7.最后一點是,即便pLDDT置信度值高于80,AF預測的結(jié)構(gòu)與實驗的晶體結(jié)構(gòu)仍然存在差異!
8. 其他的尚未發(fā)現(xiàn)的可能影響AF預測精度的因素...
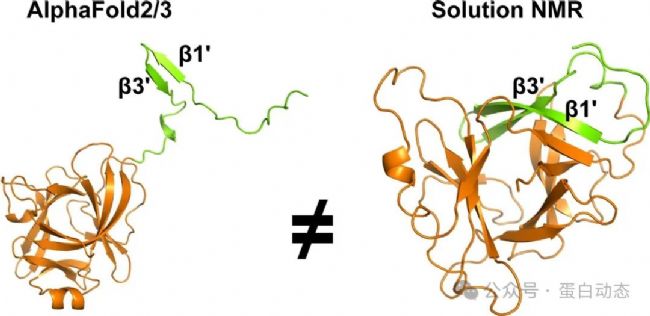
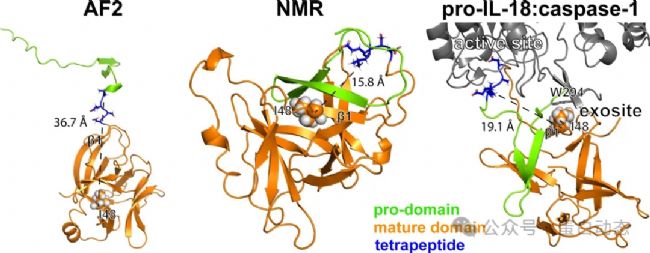
本文介紹屬于8 (即不在常見的1-7類) 的一個案例,AF無法正確預測其結(jié)構(gòu)但是給出了很高的置信度,這表明AF預測的結(jié)構(gòu)并不是100%真實的,基于實驗的結(jié)構(gòu)解析或者驗證仍必不可少!如下圖所示,AF2/3預測的蛋白結(jié)構(gòu)與液體核磁解析的結(jié)構(gòu)存在較大差異,其中最明顯的是N端 (1-36) 的兩個β片:
詳細的結(jié)構(gòu)差異有以下幾點:
1.N端的pro-domain (1-36) 在AF結(jié)構(gòu)中遠離蛋白核心區(qū)域而在液體核磁結(jié)構(gòu)中則是作為其一部分,除此以外,β片的長度也不同,實驗結(jié)構(gòu)的β片更長;
2. 除pro-domain外,其他蛋白折疊區(qū)域 (βAF和αAF) 也存在較大差異,表現(xiàn)為二級結(jié)構(gòu)的位置和長度均不一致;
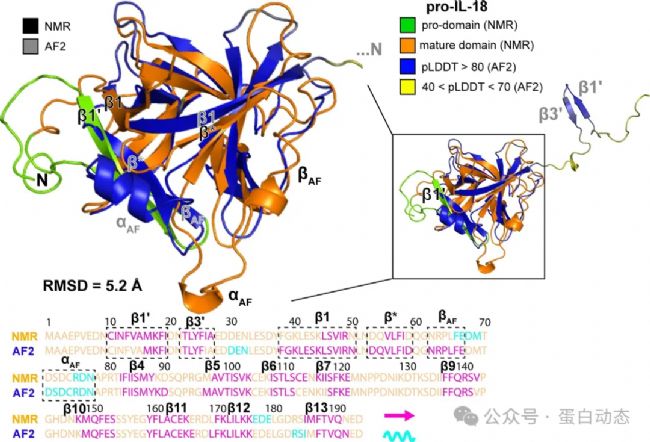
3. β1和β*的位置長度和位置差異較大,二者主鏈RMSD為13.3 Å,值得注意的是,此區(qū)域為結(jié)合底物蛋白caspase-1/4的區(qū)域之一。具體見下圖:
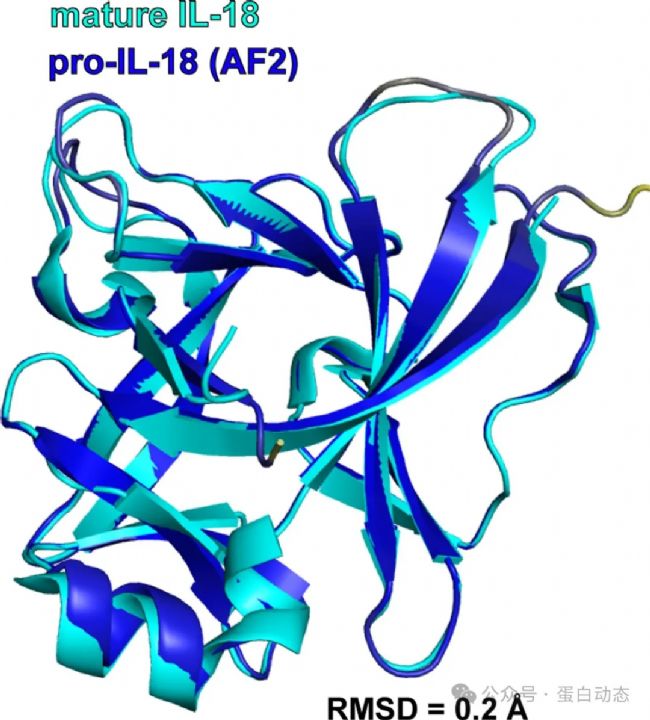
雖然AF預測的IL-18前體蛋白與實驗結(jié)構(gòu)差異較大,作者發(fā)現(xiàn)AF預測的結(jié)構(gòu)與成熟的IL-18 (即1-36被caspase-1/4切割后) 的構(gòu)象吻合得非常好,二者RMSD僅為0.2Å:
通過比較IL-18前體蛋白與caspase-1的復合物結(jié)構(gòu),作者發(fā)現(xiàn)液體核磁結(jié)構(gòu)可以更好地結(jié)合caspase-1從而被其切割為成熟體,而AF預測的結(jié)構(gòu)則不利于與caspase-1的相互作用。原因有三點:
1)caspase-1與pro-IL-18的采取一種“雙結(jié)合位點”的結(jié)合模式,即除活性區(qū)域 (pro-domain) 外,位于β1的Ile48與caspase-1中 294位的色氨酸存在相互作用。在AF2預測結(jié)構(gòu)中,二者距離較遠不利于同時與caspase-1發(fā)生相互作用,因此可能影響與caspase-1的結(jié)合;
2)AF2預測的結(jié)構(gòu)中,pro-IL-18的切割位點 (33-LESD-36) 處臨近β1,而在實驗結(jié)構(gòu)中它位于一段柔性較高的無結(jié)構(gòu)區(qū)域而更利于被caspase-1處理;
3)AF2預測結(jié)構(gòu)中,單獨的、伸展的pro-domain在細胞內(nèi)更容易被其他蛋白酶非特異性切割,不利于IL-18正確地發(fā)揮生物功能:
本文提供的這個例子非常直觀地表明AF2尚不能完全替代實驗結(jié)構(gòu),最好的方法便是結(jié)合AF2與實驗數(shù)據(jù)更快、更準確地對蛋白結(jié)構(gòu)進行解析,這一策略將在后續(xù)詳細地介紹,也是現(xiàn)在的研究前沿和熱點。
參考文獻:
1.Bonin et.al., Journal of Magnetic Resonance, 2024.
2.Terwilliger et.al., Nature Methods, 2024.
3.Agarwal et.a., Nature Chemical Biology, 2024.