重度免疫缺陷小鼠助力腫瘤研究 - 免疫治療熱門靶點CD47

想獲得國自然選題思路,提高國自然基金申請命中率?想調整研究方向,獲得學術研究突破口?有機會發高分文章?你需要了解學科發展態勢和未來走向!賽業生物專欄《Gene of the Week》每周會根據熱點研究領域介紹一個基因,詳細為您介紹基因基本信息、研究概況和應用背景等,助您保持學術研究敏銳度,提高科學研究效率,期待您的持續關注哦。今天我們要講的主角是免疫治療熱門靶點CD47。
CD47又稱為整合素相關蛋白(integrin-associated protein, IAP),屬于免疫球蛋白超家族,是一個擁有5個跨膜域的跨膜糖蛋白,廣泛表達于幾乎所有的正常細胞表面。目前已知的CD47的天然配體有三種:整合素(integrin)、血小板反應蛋白-1(Thrombospondin-1,TSP-1)和信號調節蛋白α(Signal-regulatory proteinα,Sirpα)。CD47與其配體主要參與細胞黏附、細胞遷移、吞噬功能,以及維持機體免疫穩態。
其中,Sirpα的表達局限于巨噬細胞、樹突狀細胞以及神經細胞表面。在免疫反應中,CD47主要通過與巨噬細胞表面的Sirpα結合,釋放一個“別吃我”信號,從而保證正常細胞不被巨噬細胞“吃掉”(圖1)。在這里,CD47扮演了一個“自我(self)”細胞的標記,而一些腫瘤細胞也會利用CD47/Sirpα信號通路,高表達CD47以實現免疫逃逸。
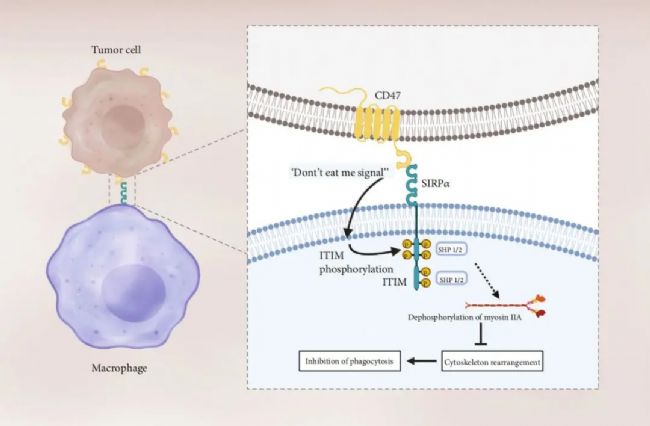
圖1. CD47/Sirpα在抑制巨噬細胞的吞噬功能中起到重要作用[1] CD47/Sirpα的相互作用導致Sirpα胞內域的免疫受體酪氨酸相關的抑制性基序(immunoreceptor tyrosine-based inhibition motif,ITIM)中的兩個酪氨酸殘基磷酸化。磷酸化招募并激活蛋白酪氨酸磷酸酶SHP1和SHP2,傳導一系列信號使肌球蛋白II去磷酸化,抑制細胞骨架重排,而這個步驟是巨噬細胞吞噬靶細胞的必要步驟。在腫瘤細胞中,CD47/Sirpα活性的增強是通過提高CD47的表達量達到的。
與T細胞抑制性免疫檢查點PD-L1類似,CD47屬于巨噬細胞抑制性免疫檢查點。近年來,許多研究者報道使用抗CD47/Sirpα抗體來阻斷CD47/Sirpα信號通路可以顯著地抑制腫瘤的生長和轉移[2],因此這條信號通路成為繼PD-1/PD-L1、CTLA-4后的另一熱門腫瘤免疫治療靶點(圖2)。但同時,靶向CD47的免疫檢查點抑制劑研發也是頗具挑戰性的:例如,由于血細胞也表達CD47,因此在藥物設計和臨床劑量上要著重考慮血液毒性這一因素。
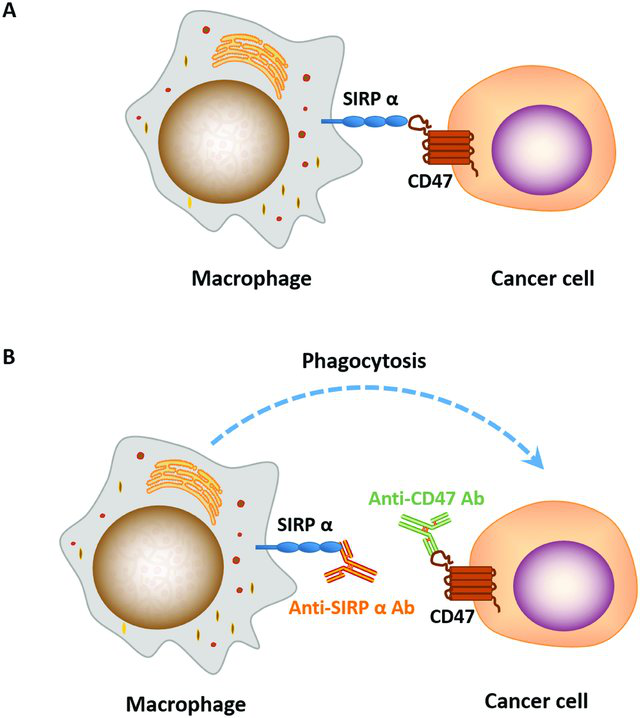
圖2. 抗CD47/SIRPɑ抗體的作用示意圖[2] 巨噬細胞上的SIRPɑ與腫瘤細胞表面的CD47結合,抑制巨噬細胞對腫瘤細胞的吞噬作用。(B)加入抗CD47/SIRPɑ抗體后,抗體阻斷了巨噬細胞上的SIRPɑ與腫瘤細胞表面的CD47的結合,巨噬細胞對腫瘤細胞進行吞噬。
此外,物種間CD47具有不相容性,也就是說一般來說,普通小鼠的Sirpα不能識別人源CD47(hCD47),這導致人源細胞容易被小鼠巨噬細胞吞噬。因此進行人源腫瘤細胞系異種移植(cell-derived xenograft,CDX)、人源腫瘤組織異種移植(patient-derived,PDX)時,異種移植效果差;使用人外周血單個核細胞(peripheral blood mononuclear cell,PBMC)和人造血干細胞(hematopoietic stem cell,HSC)進行人免疫系統重建時,人源化效果也不好。但是,特別地,NOD背景小鼠的Sirpα帶有突變(SirpαNOD),可以與hCD47結合,并且它們間的親和力甚至比hSirpα與hCD47間的親和力強10倍[3]。因此,SirpαNOD可以有效抑制小鼠巨噬細胞對人源細胞的吞噬作用,擁有SirpαNOD的免疫缺陷小鼠對CDX和PDX高度兼容(例如賽業生物的C-NKG重度免疫缺陷小鼠、BRGSF重度免疫缺陷小鼠)。
綜上,盡管面臨著挑戰,CD47仍然是一個被看好的免疫治療靶點。這從2020年3月,制藥巨頭Gilead公司重金(約49億美元)收購主打CD47抗體開發的Forty Seven公司就可見一斑。未來,抗CD47抗體有望成為繼PD-1、PD-L1、CTLA-4后的第四類獲批上市免疫檢查點抑制劑嗎?我們拭目以待。
賽業生物重度免疫缺陷小鼠助力腫瘤研究
01 BRGSF小鼠表型信息和應用
1. BRGSF小鼠是技術成熟、免疫缺陷程度最大的一種免疫缺陷小鼠,相比于目前常見的N*G小鼠,BRGSF小鼠的免疫細胞中不僅淋系細胞完全缺失,其髓系細胞(如巨噬細胞)功能也嚴重缺失,因此其用于腫瘤CDX、PDX模型建立的效果更為優秀,適合抗腫瘤藥物的藥理和藥效學研究。
2. 在基因治療領域,BRGSF小鼠同樣具有其獨特的優勢,例如CAR-T治療領域,由于BRGSF小鼠為BALB/c背景,其體內存在補體依賴性細胞毒性(CDC)機制,因此我們可研發或尋找利用CDC機制來消除治療結束后殘留的CAR-T細胞的藥物,從而降低CAR-T治療的毒副作用。
02 C-NKG小鼠表型信息和應用
1. C-NKG小鼠是賽業生物通過CRISPR/Cas9 技術在NOD/Shi-Scid背景品系上敲除Il2rg基因自主研發的一種重度免疫缺陷小鼠。
2. 缺乏成熟的T、B、NK免疫細胞,補體活性降低,巨噬細胞對人源細胞吞噬作用弱,可高效地移植人造血干細胞(HSC)、外周血單個核細胞(PBMC)、人源腫瘤細胞系異種移植(CDX)、人源腫瘤組織異種移植(PDX)。
3. 是目前公認的免疫缺陷程度高,用于腫瘤、免疫、自身免疫性疾病、免疫治療疫苗、GvHD/移植、安全性評估等研究的優秀模型。
References:
[1] Rodrigo C., et al. CD47-SIRPα Axis as a Biomarker and Therapeutic Target in Cancer: Current Perspectives and Future Challenges in Nonsmall Cell Lung Cancer. Jornal of Immunology Research, 2020.
[2] Lu, Quansheng , et al. Potential New Cancer Immunotherapy: Anti-CD47-SIRPαAntibodies. OncoTargets and Therapy, 13:9323-9331(2020).
[3] Lai, Shan, Kwong, et al. Signal-regulatory proteinαfrom the NOD mouse binds human CD47 with an exceptionally high affinity - implications for engraftment of human cells. Immunology, 2014.