2021第二屆生物藥質(zhì)量科學大會通知

將質(zhì)量理念融入研發(fā)分析與生產(chǎn)管理
時間:2021年5月25-26日
地點:中國,北京
規(guī)模: 1000 人
主辦方:中國醫(yī)藥設備工程協(xié)會
協(xié)辦單位:佰傲谷(生物醫(yī)藥領先聚合社區(qū))
承辦方:北京嘉壹會議服務有限公司
合作媒體:生物制藥小編、藥渡、新藥創(chuàng)始人俱樂部、藥學進展、制藥在線、中國生物器材網(wǎng)、肽度、醫(yī)藥合作投融資聯(lián)盟、藥融圈、藥通社、藥物一致性評價、藥物分析之家、藥物簡訊,生物探索等 40 家頂尖媒體助陣報道,同步今日頭條、騰訊新聞、網(wǎng)易新聞、雪球等媒體發(fā)布
一、亮點
﹡國內(nèi)第一個聚焦生物藥質(zhì)量領域的千人分析科學大會,10+生物藥質(zhì)量大拿聯(lián)合策劃;
﹡五大論壇+短培訓+衛(wèi)星會+直播,深度和廣度并存,全方面滿足參會者不同需求;
﹡從監(jiān)管考量到企業(yè)實踐,抽絲剝繭,探索不同新政背后的合規(guī)要求;
﹡從分析研發(fā)到生產(chǎn)質(zhì)量管理,深耕 QC、QA 體系標準,做到生物醫(yī)藥質(zhì)量方向的全產(chǎn)業(yè)鏈內(nèi)容;
﹡監(jiān)管機構、生物制藥行業(yè)上下游企業(yè)同聚一堂,共同探討產(chǎn)業(yè)發(fā)展中的問題,促進行業(yè)不斷進步。
二、大會背景
藥品是生命安全的保障,因為其特殊性,藥品質(zhì)量的管控應該是重中之重。國內(nèi)打出“質(zhì)量”口號的藥企不少,但到了關鍵時刻,質(zhì)量往往被置于次要地位。這兩年,隨著國家藥監(jiān)政策的不斷出臺,“四個最嚴”和飛行檢查的常態(tài)化,質(zhì)量要求越來越嚴是趨勢,藥企質(zhì)量部門需要更多高素質(zhì)的人員來監(jiān)管藥品質(zhì)量,并且一致性評價和藥品研發(fā)也需要將質(zhì)量延伸到藥品整個生命周期,真正實現(xiàn)“質(zhì)量源于設計”的理念。
大分子生物藥由于結構復雜、質(zhì)控難度大,隨著技術的發(fā)展,不同檢測方法、儀器的更新都在促進我們對分析和藥物研究有更深一層的了解。
地點:中國,北京
規(guī)模: 1000 人
主辦方:中國醫(yī)藥設備工程協(xié)會
協(xié)辦單位:佰傲谷(生物醫(yī)藥領先聚合社區(qū))
承辦方:北京嘉壹會議服務有限公司
合作媒體:生物制藥小編、藥渡、新藥創(chuàng)始人俱樂部、藥學進展、制藥在線、中國生物器材網(wǎng)、肽度、醫(yī)藥合作投融資聯(lián)盟、藥融圈、藥通社、藥物一致性評價、藥物分析之家、藥物簡訊,生物探索等 40 家頂尖媒體助陣報道,同步今日頭條、騰訊新聞、網(wǎng)易新聞、雪球等媒體發(fā)布
一、亮點
﹡國內(nèi)第一個聚焦生物藥質(zhì)量領域的千人分析科學大會,10+生物藥質(zhì)量大拿聯(lián)合策劃;
﹡五大論壇+短培訓+衛(wèi)星會+直播,深度和廣度并存,全方面滿足參會者不同需求;
﹡從監(jiān)管考量到企業(yè)實踐,抽絲剝繭,探索不同新政背后的合規(guī)要求;
﹡從分析研發(fā)到生產(chǎn)質(zhì)量管理,深耕 QC、QA 體系標準,做到生物醫(yī)藥質(zhì)量方向的全產(chǎn)業(yè)鏈內(nèi)容;
﹡監(jiān)管機構、生物制藥行業(yè)上下游企業(yè)同聚一堂,共同探討產(chǎn)業(yè)發(fā)展中的問題,促進行業(yè)不斷進步。
二、大會背景
藥品是生命安全的保障,因為其特殊性,藥品質(zhì)量的管控應該是重中之重。國內(nèi)打出“質(zhì)量”口號的藥企不少,但到了關鍵時刻,質(zhì)量往往被置于次要地位。這兩年,隨著國家藥監(jiān)政策的不斷出臺,“四個最嚴”和飛行檢查的常態(tài)化,質(zhì)量要求越來越嚴是趨勢,藥企質(zhì)量部門需要更多高素質(zhì)的人員來監(jiān)管藥品質(zhì)量,并且一致性評價和藥品研發(fā)也需要將質(zhì)量延伸到藥品整個生命周期,真正實現(xiàn)“質(zhì)量源于設計”的理念。
大分子生物藥由于結構復雜、質(zhì)控難度大,隨著技術的發(fā)展,不同檢測方法、儀器的更新都在促進我們對分析和藥物研究有更深一層的了解。
本大會旨在讓有一定基礎的藥企人員通過為期兩天的大會,全面提升研發(fā)注冊與質(zhì)量生產(chǎn)管理人員的工作技能,幫助國內(nèi)企業(yè)提升藥品質(zhì)量和健全質(zhì)量管理體系,與國際規(guī)范接軌。
三、議題
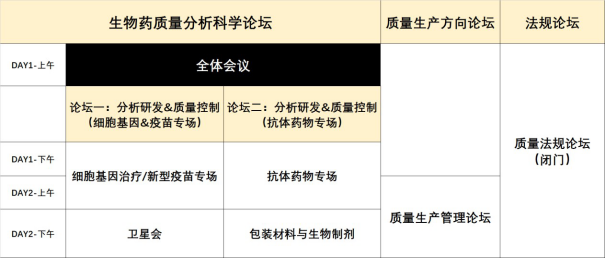
三、議題

| 政策法規(guī) |
| 1,如何將QbD 應用于藥物研發(fā)的注冊申報 2,生物藥品的注冊核查新要求/程序 3,從監(jiān)管的角度解讀生物制品常見發(fā)補內(nèi)容 4,中美申報上市藥品風險評估和應對的思考 5,藥品在中美歐奧等多國家注冊及與藥監(jiān)機構溝通要點 6,疫苗追溯體系及生產(chǎn)檢測信息化的法規(guī)要求解讀 7,淺談新法規(guī)框架下藥品加快上市注冊程序變化 8,淺析創(chuàng)新藥藥學審評的策略及相關技術要求 9, 監(jiān)管對質(zhì)量審計追蹤的審核和管理有哪些期望 10, 新版《中國藥典》方法驗證變更解讀 11, 審評、生產(chǎn)現(xiàn)場檢查監(jiān)管會關注哪些方面 12, 歐盟申報相關法規(guī)要求與難點解析 13, 細胞基因治療產(chǎn)品 IND 評審要點 14, 對于實驗室調(diào)查與分析方法生命周期管理方面的規(guī)定與解讀 15, ICH Q6B 生物技術/生物產(chǎn)品的檢驗程序和可接收標準研讀 16,《治療性蛋白產(chǎn)品的免疫原性檢測方法開發(fā)和驗證》指導原則 17,《生物安全法》的相關解讀及對產(chǎn)業(yè)的影響 18, 生物制品藥典附錄解讀 19, 關于市場或供應鏈安全:全球疫苗供應體系 |
| 全體大會 |
| 1. 新形勢·新階段·新思考——全球生物新藥質(zhì)量監(jiān)管趨勢分析與應對 2. 藥明生物-中國最大的 CDMO 是如何管理質(zhì)量的? 3. 從藥品檢驗技術的應用看我國藥品質(zhì)量控制的發(fā)展 4. 制藥行業(yè)質(zhì)量檢測發(fā)展趨勢:自動化替代 5. 圓桌討論:全方位探討 QA 的正確定位和戰(zhàn)略意義 |
| 論壇一(生產(chǎn)質(zhì)量管理論壇) |
| ICH Q13與連續(xù)化制造 ADC商品化生產(chǎn)質(zhì)量關注點 《生物制品MAH的全生命周期質(zhì)量管理》 實時放行PAT技術 生物藥原液不銹鋼設施的設計、建設和驗證 在滿足監(jiān)管的條件下實現(xiàn)抗體藥物的工藝改進與工藝變更的關鍵考慮 生物制藥的連續(xù)化制造 關于疫苗MAH GS1 實施現(xiàn)狀和展望 單抗藥物生產(chǎn)設施暖通設計要點探討 |
| 論壇二(分析研發(fā)&質(zhì)量控制論壇——抗體藥物) |
| 生物制品研發(fā)質(zhì)量管理體系的建立——從細胞株到產(chǎn)品上市 臨床試驗/產(chǎn)業(yè)化階段工藝變更或放大的質(zhì)量可比性研發(fā) 創(chuàng)新質(zhì)譜的應用成就大分子藥物開發(fā) 新規(guī)下如何制定分析方法轉移方案和驗收標準 聚體表征的研究進展及案例分析 從 IND 到 BLA:雜質(zhì)研究要求的“異與同” 抗體藥物生產(chǎn)過程中工藝相關雜質(zhì)的控制策略 統(tǒng)計學在生物藥研發(fā)中的應用當初 抗體偶聯(lián)藥物ADC 電荷異質(zhì)性分析 雙特異性抗體工藝開發(fā)中的雜質(zhì)研究和控制 HCPs 的表征研究進展 可見異物鑒定及來源的調(diào)查研究 復雜樣品 MAM 多質(zhì)量屬性方法開發(fā)與應用 氫/氘交換質(zhì)譜法表征復雜結構抗體類藥物的應用 重組蛋白藥物表征分析的難點解析 |
| 論壇三(分析研發(fā)&質(zhì)量控制論壇——細胞基因&新型疫苗) |
| 基因治療產(chǎn)品成藥性思考和可開發(fā)性評估 CAR-T 藥物質(zhì)量控制方法及注冊檢驗相關問題分享 不同 CE 平臺測定AAV 衣殼純度的案例分析 細胞治療產(chǎn)品中流式細胞術檢測方法開發(fā)與驗證 合規(guī)的QC 實驗室管理運營模式 細胞治療產(chǎn)品質(zhì)量標準制定的關鍵要點 CAR-T 藥物活性方法開發(fā)策略及案例 mRNA 疫苗質(zhì)量研究進展及監(jiān)管要求 疫苗的質(zhì)量分析和質(zhì)量標準的建立 基因毒性雜質(zhì)分析方法實踐案例分享 CAR-T 制品中殘留物的分析策略 實驗室數(shù)據(jù)管理:復雜色譜圖積分問題探討 如何實現(xiàn)細胞制劑產(chǎn)品放行檢快檢 |
四、擬邀嘉賓
左樹巖博士,世界衛(wèi)生組織駐北京辦事處EPI組國家技術官員
Laurimer Kuilan-Torres女士 FDA駐華辦
Michael Garvey先生,百濟神州副總裁
周新華先生,嘉和生物藥業(yè)有限公司總裁
Marcello Colao,GSK 疫苗全球質(zhì)量負責人
Diana Lee Francis,百濟神州副總裁、全球質(zhì)量及合規(guī)監(jiān)管負責人
李樹德先生,天境生物副總裁
孫志剛,綠葉制藥集團,質(zhì)量和監(jiān)管事務高級副總裁
李敏,華海藥業(yè)副總裁,分析領域首席科學家
李壯林,榮昌生物副總裁、總工程師人
Diana Lee Francis,百濟神州副總裁、全球質(zhì)量及合規(guī)監(jiān)管負責人張伯彥,北京天廣實副總經(jīng)理兼首席科學家
王董明,信達生物質(zhì)量高級副總裁王陽,神州細胞副總經(jīng)理,董事
吉申齊,輝瑞中國區(qū)藥品注冊文件出版中心負責人王亞君,藥明巨諾質(zhì)量負責人
李和義,科濟生物分析及質(zhì)量控制副總裁鄒勇,馴鹿醫(yī)療董事兼副總裁
張萍,基石藥業(yè)質(zhì)量管理副總
黃崗,藥明生物高級副總裁,分析科學家饒春明,中檢院生檢所重組藥物室主任
劉伯寧,華北制藥集團新藥研究開發(fā)有限責任公司抗體藥物研制國家重點實驗室張克洲,諾和諾德大中國區(qū)醫(yī)藥質(zhì)量部企業(yè)副總裁
……
五、參會群體
Bio-Tech/Pharm :質(zhì)量部 QA/QC 部、研發(fā)部、制劑部、注冊部、工藝開發(fā)部、技術部、生產(chǎn)部、臨床藥理人員、醫(yī)學事務部、項目管理及公司高管相關人員;
院校/監(jiān)管機構:科研人員、法規(guī)專家、注冊申報、審查人員;
第三方技術服務/咨詢公司: CRO、CDMO、法規(guī)咨詢、質(zhì)量檢測服務從業(yè)人員等。
左樹巖博士,世界衛(wèi)生組織駐北京辦事處EPI組國家技術官員
Laurimer Kuilan-Torres女士 FDA駐華辦
Michael Garvey先生,百濟神州副總裁
周新華先生,嘉和生物藥業(yè)有限公司總裁
Marcello Colao,GSK 疫苗全球質(zhì)量負責人
Diana Lee Francis,百濟神州副總裁、全球質(zhì)量及合規(guī)監(jiān)管負責人
李樹德先生,天境生物副總裁
孫志剛,綠葉制藥集團,質(zhì)量和監(jiān)管事務高級副總裁
李敏,華海藥業(yè)副總裁,分析領域首席科學家
李壯林,榮昌生物副總裁、總工程師人
Diana Lee Francis,百濟神州副總裁、全球質(zhì)量及合規(guī)監(jiān)管負責人張伯彥,北京天廣實副總經(jīng)理兼首席科學家
王董明,信達生物質(zhì)量高級副總裁王陽,神州細胞副總經(jīng)理,董事
吉申齊,輝瑞中國區(qū)藥品注冊文件出版中心負責人王亞君,藥明巨諾質(zhì)量負責人
李和義,科濟生物分析及質(zhì)量控制副總裁鄒勇,馴鹿醫(yī)療董事兼副總裁
張萍,基石藥業(yè)質(zhì)量管理副總
黃崗,藥明生物高級副總裁,分析科學家饒春明,中檢院生檢所重組藥物室主任
劉伯寧,華北制藥集團新藥研究開發(fā)有限責任公司抗體藥物研制國家重點實驗室張克洲,諾和諾德大中國區(qū)醫(yī)藥質(zhì)量部企業(yè)副總裁
……
五、參會群體
Bio-Tech/Pharm :質(zhì)量部 QA/QC 部、研發(fā)部、制劑部、注冊部、工藝開發(fā)部、技術部、生產(chǎn)部、臨床藥理人員、醫(yī)學事務部、項目管理及公司高管相關人員;
院校/監(jiān)管機構:科研人員、法規(guī)專家、注冊申報、審查人員;
第三方技術服務/咨詢公司: CRO、CDMO、法規(guī)咨詢、質(zhì)量檢測服務從業(yè)人員等。
- BSI邀您參加全國糖生物學會議暨全國糖化學會議
- 千奧星科邀您參加2025年度神經(jīng)科學前沿技術培訓班
- 禮智生物邀您蒞臨神經(jīng)科學前沿技術培訓班
- 譜鐳邀您共赴喀什第三屆先進成像與信息處理會議
- 超維景將參展神經(jīng)科學學會2025神經(jīng)科學技術培訓班
- 第八屆腫瘤免疫及伴隨診斷合作峰會通知
- OTC2025類器官前沿應用與3D培養(yǎng)論壇倒計時5天
- 易科泰邀您參加第十三屆動物生理生態(tài)學學術研討會
- 艾貝泰將攜生物反應器等參加BIONNOVA西部創(chuàng)新論壇
- 進科馳安攜手ApogeeFlow順利參加2025細胞外囊泡大會
- 2025第九屆(蘇州)生物藥創(chuàng)新開發(fā)峰會通知
- 2025第十九屆(蘇州)細胞產(chǎn)業(yè)大會通知
- 超維景精彩亮相冷泉港亞洲會議(CSHA)并作報告
- ICOMES公司攜多款分配器亮相第30屆機械元件技術展
- 因美納邀您參加CSCO第九屆血液腫瘤學術大會
- 2025年亞洲生物創(chuàng)新峰會•新加坡站通知
- 2025第九屆(蘇州)生物藥創(chuàng)新開發(fā)峰會通知
- CPHI&PMEC 2025制藥工業(yè)展(深圳)通知
- 關于征集藥食同源及藥膳配方食品標準試點單位的通知
- 關于征集藥食同源優(yōu)選產(chǎn)品評價規(guī)范參編單位的通知
- BioCon 2025生物藥全生命周期技術年會即將開幕
- 2025大灣區(qū)生物醫(yī)藥與醫(yī)療健康產(chǎn)業(yè)博覽會通知
- 2025BPD上海第八屆生物藥工藝發(fā)展大會最新日程
- 第八屆西部(成都)生物醫(yī)藥及技術裝備展覽會通知
- 2025第九屆亞太生物醫(yī)藥合作峰會路演征集
- 江西生物醫(yī)藥產(chǎn)業(yè)鏈發(fā)展大會暨技術裝備博覽會通知
- RadioPharm Asia亞洲放射性藥物研發(fā)領袖峰會通知
- 2025 CNS Asia Week藥物開發(fā)產(chǎn)業(yè)周通知
- 2025第93屆API國際醫(yī)藥原料及中間體設備交易會
- 2025高端科技人才暨第四屆生物醫(yī)藥產(chǎn)業(yè)大會通知
Copyright(C) 1998-2025 生物器材網(wǎng) 電話:021-64166852;13621656896 E-mail:info@bio-equip.com






